Retour au sommaire du dossier |
Retour à l'accueil
Mobilités électrophorétiques
(pour les électrophorèses dites de zones)
1. Mobilité d'une particule chargée supposée
unique soumise à l'action d'un champ électrique uniforme
On suppose l'expérience de pensée suivante :
Une particule unique de charge q et de rayon hydrodynamique équivalent r est soumise
à un champ électrique E au sein d'un milieu neutre de viscosité η.
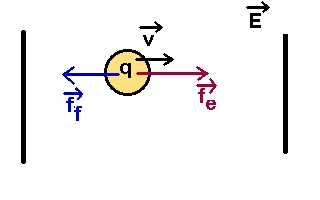 |
La particule est soumise à une force électrique de norme fe = q E .
La particule prend donc de la vitesse (v) et devient soumise à une force de frottement ff de norme
= 6 π η r v .
Elle accélère jusqu'à atteindre une vitesse constante pour laquelle :
fe = q E = ff = 6 π η r v
Qui donne l'égalité :
v = (q/6πηr)*E
|
Conclusion. La vitesse de migration devient constante, elle est proportionnelle à la valeur du
champ électrique appliqué et à un facteur qui ne dépend que de la charge de la particule, de son
rayon hydrodynamique équivalent et de la viscosité du milieu, facteur appelé mobilité limite μl.
μl = v / E = q / (6πηr)
E s'exprime en V/m ; v en m/s donc μl en m2V-1s-1
Le rapport q/r est généralement appelé densité de charge de la particule. |
retour en haut de page
2. Mobilité électrophorétique de particules
chargées P, sous
l'action d'un champ électrique uniforme, dans un liquide de pH tamponné et de force ionique donnée
Il s'agit maintenant de se placer dans un cadre expérimental plus réel.
On considère des particules (macromolécules) chargées en
solution dans un liquide de pH tamponné et de force ionique fi. On suppose que le champ électrique est uniforme et
que le liquide tamponné est homogène et demeure inchangé, homogène tout au long
de la manipulation (il suffit pour cela que les compartiments anodique et cathodique
soient de volume élevé).
Chaque particule (représentée en marron, supposée sphérique, de rayon r, et avec une distribution symétrique de son électricité)
baigne dans un liquide qui contient des cations et des anions. La charge globale du milieu est nulle.
Chaque particule est entourée d'ions proches (on parle de son nuage d'ions) ; la charge q n'est pas sans effet sur la distribution des ions du nuage.
Le nuage d'ions contient à la fois des
cations et des anions mais annule globalement la charge q (soit q la charge de la particule,
la charge nette du nuage est de -q). Sur le schéma, on a représenté le nuage en bleu, il est sphérique puisqu'on a
supposé une particule sphérique à distribution d'électricité uniforme.
|
|
|
|
Si on applique un champ électrique E au système, chaque particule (ici supposée sphérique et avec une distribution symétrique de son électricité)
va se mettre en mouvement et va atteindre une vitesse v uniforme. Cette vitesse sera atteinte très rapidement lorsque les 4 forces qui
s'exercent sur la particule auront une somme vectorielle nulle.
Présentons les 4 forces :
la force fedue à l'application du champ électrique sur la particule
de charge q. fe = q E
la force de frottement ff due à la vitesse v dans un milieu de viscosité η.
ff = 6 π η r v
Sous l'effet du champ électrique, les ions de l'atmosphère ionique se déplacent dans une direction globalement opposée à celle de chaque particule de charge q
(puisque la charge globale du nuage est de -q). Ces ions entraînent avec eux des molécules
de solvant (une sorte d'osmose locale) de sorte que chaque particule de charge q se heurte à un contre courant de solvant qui la freine.
Appelons fret, forces de retard électrophorétique, ce freinage.
On vient de voir que le nuage ionique autour de chaque particule se déplace globalement en sens opposé à celle-ci.
Conclusion : la distribution électrique globale présente en absence de champ électrique
est rompue. Les barycentre des charges + et - ne coincident plus. C'est comme si le nuage
tendance créait un micro champ électrique local qui rappelle chaque particule.
Appelons frap ces forces coulombiennes de rappel.
|
|
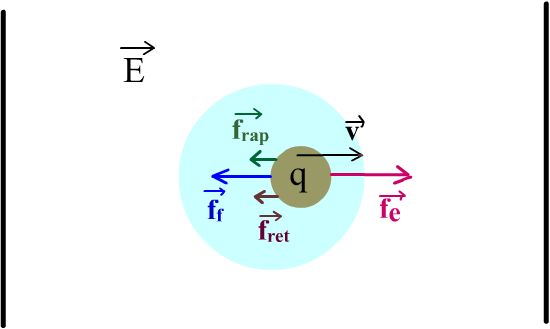 |
Quel est le bilan global du jeu des 4 forces ? Chaque particule va atteindre une vitesse (v)
de migration constante lorsque fe = ff + fret + frap ; soit :
q E = 6 π η r v + fret + frap ; soit :
v = ((q - fret + frap) /(6 π η r)) * E
Ainsi, si on appelle µr la mobilité d'une particule dans le système d'électrophorèse, on a :
µr = v / E = (q - fret + frap) /(6 π η r)
On retrouve évidemment une formule proche de la formule vue au paragraphe précédent, celle de la mobilité limite µl.
Sans considérations théoriques poussées, on remarque que µr < µl.
On peut montrer que plus la force ionique du milieu de pH tamponné augmente, plus fret et frap augmentent et donc plus la
mobilité diminue par rapport à la mobilité limite.
On peut l'écrire µr = γ µl avec γ < 1 et γ d'autant plus faible que fi est élevée.
Ce qui en fait n'est pas très génant pour la
séparation de particules lors d'une électrophorèse :
Il reste vrai que plus la densité de charge d'une
particule est élevée, plus elle migre vite dans un système électrophorétique donné. Les mobilités limites et
les mobilités électrophorétiques réelles obtenues dans un liquide tamponné donné sont dans le même ordre ! La mobilité effective réalisée
dans un liquide de pH tamponné donné reste définie comme le rapport de la vitesse au champ électrique (en m2V-1s-1) !!
retour en haut de page
3. Mobilité electrophorétique dans le cadre
de montages techniques particuliers
3.1 Mobilités électrophorétiques et
électrophorèses de zones en veine liquide imprégnant un support poreux
On peut présenter ainsi les montages d'électrophorèses de zones sur support poreux :
Un support poreux (en pratique de l'acétate de cellulose, un gel de polyacrylamide, ou un gel d'agarose)
est imprégné d'un électrolyte de pH tamponné. Cet électrolyte remplit les deux réservoirs anodiques et cathodiques au contact
du support. Les 2 réservoirs d'électrolyte sont de volume suffisamment élevé pour qu'on puisse
négliger l'évolution de la composition de l'électrolyte en cours d'électrophorèse (en toute rigueur cette
composition évolue puisqu'il y a migration d'ions de l'électrolyte et électrolyse de l'électrolyte).
La charge de l'échantillon à analyser en ses différents constituants à séparer est faible
devant la concentration en ions de l'électrolyte de sorte qu'on peut considérer que le champ électrique est constant.
Ce type de montage va conduire à différents phénomènes qu'il convient de mentionner.
Le problème de l'apparition des courants de convection.
Qui dit électrophorèse dit intensité de courant et donc effet Joule, production de chaleur. Le dégagement de chaleur se traduit
par l'apparition de courants liquidiens de convection au sein du support poreux. Ces courants élargissent
les zones de séparation : le pouvoir séparatif est diminué !
Pour minimiser ce phénomène, on travaille sous des intensités de courant pas trop élevées
et on réfrigère en cours de manipulation.
On verra au paragraphe 3.2 que les techniques en électrophorèse capillaire permettent une diffusion parfaite de la chaleur
sous des champs appliqués très importants. Les convections sont évitées , la résolution est très élevée...
Les supports chargés qui conduisent à de l'électroendosmose.
Certains supports portent des goupements chimiques chargés : c'est la cas des supports acétate de cellulose
et des agaroses pas totalement désulfatés qui portent des groupements à charge négative. De tels support
entraînent l'apparition d'un courant liquidien : du pôle positif au pôle négatif dans la cas des supports à charges négatives.
Ce courant liquidien est lié à la migration électrophorétique des contre-ions du support qui entraînent le solvant
par effet d'osmose : on parle électroendosmose liée au support.
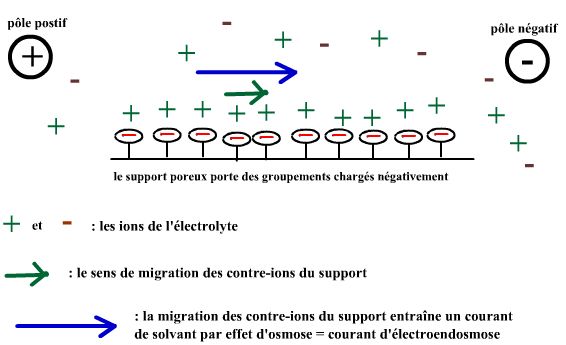 |
Comme le montre le schéma, dans le cas d'un support chargé négativement (le cas classique),
le courant d'électroendosmose est dirigé du pôle positif vers le pôle négatif : il s'oppose
à la migration électrophorétique des particules chargées négativement et augmente la vitesse de migration des
particules chargées positivement. |
L'utilisation de l'acétate de cellulose comme support d'électrophorèse tend à disparaître. Les agaroses plus ou moins
chargés restent utilisés pour des techniques de séparation de protéines qui ne nécessitent pas un
pouvoir de résolution très élevé. On peut aussi citer la technique d'électroimmunodiffusion quantitative de
Laurell qui met en oeuvre un agarose sulfaté (à électroendosmose) imprégné par un tampon de pH 9,2 chargé en immunoglobulines (anticorps). Dans un tel
système, l'électroendosmose liée au support contrarie très exactement la faible mobilité électrophorétique des anticorps dans le tampon
pH 9,2 (les anticorps ont un pHi élevé) : les anticorps ont une mobilité globale nulle. Ils vont rester en place dans le gel et seront recrutés au fur et à mesure
par un antigène en migration électrophorétique ... voir un cours spécialisé à ce sujet ...
On verra dans le paragraphe 3.2 l'importance de l'électroendosmose dans les techniques d'électrophorèses capillaires.
Dans certaines techniques, on met en oeuvre des effets de tamisage moléculaire liés à la porosité du support.
Lors des techniques de séparation électrophorétique de fragments d'ADN ou de micelles SDS-unités polypeptidiques réduites (des techniques très classiques),
on met à profit le fait que les substances à séparer ont toutes la même densité de charge (à peu près). Ainsi, si
on réalisait l'électrophorèse en veine liquide sans support, les analytes à séparer auraient tous la même mobilité
électrophorétique et ne seraient donc absolument pas séparés !
Dans ces technique, on va mettre en oeuvre
un support de porosité contrôlée qui va exercer un effet de tamisage sur les analytes en migration : plus ils sont de
dimension élevée, plus ils sont freinés. On parvient ainsi à une séparation électrophorétique selon le
paramètre de taille (en fait étroitement corrélé à la masse moléculaire).
Attention ! Qui dit support imprégné n'implique pas effet de tamisage moléculaire. IL suffit de
prévoir une porosité large devant la taille des analytes à séparer et l'effet de tamisage sera nulle.
C'est le cas pour les électrophorèses de protéines sur gels d'agarose par exemple.
Voyez les chapitres concernant les électrophorèses d'acides nucléiques et la SDS-PAGE.
Les supports "ouverts" conduisent à des courants d'évaporation.
Lors de la mise en oeuvre de certaines techniques où il n'y a pas lieu de demander des performances séparatives
élevées, on travaille parfois en "milieu ouvert". La production de chaleur par effet Joule
génère alors un courant d'évaporation qui devient alors un nouveau paramètre de la mobilité. Il suffit de
travailler en "milieu fermé" pour éviter l'évaporation...
retour en haut de page
3.2 Mobilités électrophorétiques et
électrophorèses capillaires
Les électrophorèses capillaires sont traitées dans un chapitre dédié. Il est néanmoins possible
de signaler dans cette page qu'elles mettent en
oeuvre une migration électrophorétique au sein d'un liquide de pH tamponné
à l'intérieur d'un capillaire de silice. Ce type de montage permet une évacuation très efficace de la chaleur
produite par effet Joule et autorise ainsi des champs électriques très élevés avec très peu de convection :
on atteint ainsi un pouvoir séparatif très élevé. les techniques capillaires "utilisent souvent" le flux
d'électroendosmose lié aux charges négatives de la surface des capillaires de silice et des
méthodes mettant en oeuvre des interactions avec des micelles du détergent chargé SDS (sodium dodécylsulfate).
retour en haut de page



