Les couples redox en jeu sont les suivants :
Ainsi que :
Cr2O72- + 14H+ + 6e / 2Cr3+ + 7H2O

CH3C00H + 4e + 4H+ / CH3CH2OH + H2O
Cr2O72- + 14H+ + 6e / 2Cr3+ + 7H2O

Fe3+ + e / Fe2+
Remarque préalable. La méthode chromimétrique de dosage de l'éthanol après distillation de l'essai est actuellement réservée aux déterminations du titre alcoométrique de liquides faiblement concentrés en éthanol : dosage de l'éthanol résiduel des vinaigres de vin ou des môuts... Elle n'est plus utilisée pour doser l'éthanol des vins et autres boissons alcoolisées. Des informations complémentaires à ce sujet sont données en fin de page.
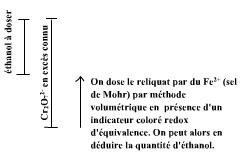
En milieu acide, l'éthanol (CH3CH2OH) est oxydé par le dichromate de potassium (K2Cr2O7). On peut ainsi réaliser un dosage en retour : on va oxyder tout l'éthanol d'un échantillon en présence d'un excès exactement connu de dichromate ; puis on va mesurer le reliquat de dichromate à l'aide d'une réaction redox avec du fer ferreux (sel de Mohr) en présence d'un indicateur coloré redox d'équivalence. Par différence, on pourra ainsi connaître la quantité d'éthanol de l'échantillon.
 |
Les couples redox en jeu sont les suivants : |
Ainsi que : |
Cr2O72- + 14H+ + 6e / 2Cr3+ + 7H2O
CH3C00H + 4e + 4H+ / CH3CH2OH + H2O |
Cr2O72- + 14H+ + 6e / 2Cr3+ + 7H2O
Fe3+ + e / Fe2+ |
Ce qui conduit aux 2 réactions :
2 Cr2O72- + 3 CH3CH2OH + 16H+ ------------> 4 Cr3+ + 3 CH3C00H + 11 H2O |
3 Ndi = 2 Neth |
Cr2O72- + 6 Fe2+ + 14H+ ------------> 2 Cr3+ + 6 Fe3+ + 7 H2O |
6 Ndi = Nfe2 |
Mais en fait, le dosage va être plus complexe car le dichromate n'est absolument pas spécifique de l'éthanol : il oxyde à température ambiante les alcools en général, les aldéhydes, les alcènes, des métaux, le fer ferreux ... Et donc on va mettre en oeuvre une étape préliminaire avant la réaction d'oxydation de l'éthanol de l'échantillon par le dichromate : on va distiller l'échantillon (il s'agit d'isoler l'éthanol pour rendre le dosage spécifique). Finalement, dans un échantillon pour lequel on peut considérer que l'éthanol est le seul produit distillable oxydé à froid par le dichromate, le dosage sera spécifique si on mesure sur une fraction du distillat obtenu ! (Et c'est le cas pour les boissons alcoolisées par exemple). En général, on alcalinise l'échantillon à distiller ce qui empêche la volatilisation de certains acides organiques éventuellement présents et qui pourraient donner une erreur par excès).
 |
|
|
 |
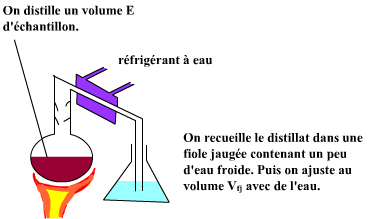
On peut utiliser un montage traditionnel comme indiqué par le schéma ci-dessus : ballon pour l'échantillon avec système de chauffage surmonté d'une colonne de distillation puis réfrigérant à eau et allonge plongeant dans une fiole jaugée contenant un peu d'eau froide. Il faudra s'assurer de l'étanchéité des connections entre les divers éléments du montage. On commencera par "rincer" le montage en distillant de l'eau. Lors de la distillation d'un échantillon il faudra faire attention à bien retirer la fiole de recueil avant de couper le système de chauffage : sinon on aura une réaspiration du distillat depuis la fiole vers la colonne !!
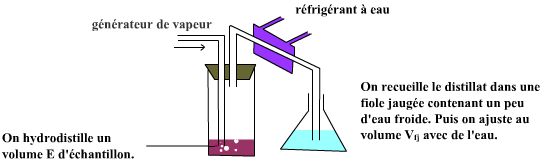
Dans de nombreux cas, on pourra utiliser un appareil à hydrodistillation du type de ceux qu'on utilise aussi pour hydrodistiller NH3 dans les dosages d'azote Kjeldahl. Comme indiqué dans la figure ci-dessous.
Mode opératoire |
Notes techniques particulières |
|
3.1 Rinçage de l'appareillage de distillationPour un montage de distillation classique : introduire environ 250 mL d’eau distillée dans le ballon à distiller. Distiller. Rejeter les produits de tête (environ 50 mL qui renferment d’éventuels résidus réducteurs volatils). Vider le ballon à distiller. Pour un appareil d'hydrodistillation : utiliser un matras parfaitement propre auquel on additionne un peu d'eau. Injecter la vapeur pendant quelques minutes et rejeter l'effluent. |
La manipulation exige une verrerie rigoureusement propre. Attention à la sécurité ! Respecter les bonnes pratiques en vigueur. |
|
3.2 Distillation de l’alcool de l’échantillon
|
Attention à la sécurité ! Respecter les bonnes pratiques en vigueur. Pour un montage à distiller classique : la distillation doit être très douce, les solutions chargées en protéines ont tendance à mousser et la mousse à monter dans la colonne. Il faut surveiller de façon continue la distillation. |
|
Distiller environ 40 mL en recueillant le distillat dans une fiole jaugée de 100 mL contenant déjà environ 15 mL d’eau distillée froide et éventuellement placée dans un bac de glace fondante (pour éviter l'évaporation de l'alcool distillé). L’allonge doit plonger dans la solution en fiole. Rincer l’allonge à la fin du temps de distillation en recueillant l'eau de rinçage dans la fiole. Ajuster la fiole jaugée avec de l’eau distillée. Boucher soigneusement. |
Attention au protocole d’arrêt de la distillation, éviter absolument les « effets d’aspiration du contenu de la fiole » (1 : on enlève la fiole ; 2 : on arrête la distillation). |
|
3.3 Dosage chromimétrique de l’éthanol distillé |
||
3.3.1 Solution de dichromate de potassium nécessairePar exemple pour 1L (volume à adapter aux besoins). Exactement 33,604 g de dichromate de potassium pur et anhydre qsp 1000 mL d'eau distillée (en fiole jaugée de 1L). On obtient ainsi une solution à 0,1142 mol/L. |
Attention aux dangers pour soi, pour les autres et pour l'environnement liés à la manipulation de dichromate de potassium poudre pour réaliser la solution 3.3.1. Il faut absolument avoir été formé et respecter les procédures et instructions de sécurité et de gestion des déchets nécessaires. Consulter aussi les données de sécurité du dichromate (annexe en fin de document). Manipulation obligatoire sous hotte chimique validée et port des équipements individuels de protection (EIP) pour réaliser la solution titrante 3.3.1 à 0,1142 mol/L. Manipulation après formation et sous hotte chimique et port des EIP en évitant tout aérosol lors de la manipulation de la solution titrante à 0,1142 mol/L flaconnée. K2Cr2O7 : 294,1846 g/mol. Une solution à 33,604 g/L est à 0,1142 mol/L. Ainsi on peut montrer que 1,00 mL de solution de dichromate oxyde exactement l’éthanol contenu dans 1,00 mL de solution éthanolique à 1% (v/v) |
|
3.3.2 Oxydation chromique de l'éthanol.
|
Attention aux dangers liés à la manipulation d'acide sulfurique concentré puis d’un mélange sulfochromique. Il faut avoir été formé et respecter les procédures et instruction de sécurité et de gestion des déchets nécessaires. |
|
3.3.3 Dosage de l'excès de solution chromique
|
L’acide orthophosphorique complexe Fe3+ et rend le virage de l’indicateur de fin de dosage plus net. Attention, l'acide orthophosphorique pur est concentré => manipuler des lunettes. porter attention à l'entourage. Il est vivement conseillé de se familiariser avec "le virage net à la goutte près" en manipulant avec un "témoin négatif" ($3.3.4 suivant) pour lequel la chute de burette attendue est connue. Les ions Cr2O72- sont orange, les ions Fe3+ sont bruns, les ions Cr3+ sont verts intense. Au fur et à mesure du dosage, les Cr2O72- diminuent tandis que les Cr3+ et les Fe3+ s'accumulent. L'indicateur utilisé est violet en milieu oxydant (c'est à dire ici tant que le dichromate est en excès) et devient incolore en milieu réducteur (c'est à dire lorsque tout le dichromate est épuisé après l'oxydation de l'éthanol puis du Fe2+ versé à la burette et qu'on verse alors du Fe2+ en excès). A la première goutte de solution de Fe2+ en excès le milieu passe de façon nette à un beau vert franc. |
|
3.3.4 Dosage de la solution de sel de Mohr ( = témoin négatif du dosage en retour)Il correspond à l’étalonnage nécessaire de la solution de sel de Mohr.
|
Sel de Mohr : formule =(FeSO4(NH4)2SO4, 6 H2O), le fer est à l’état Fe2+, solution qui se conserve mal. Masse d’une mole de (FeSO4(NH4)2SO4, 6 H2O) = 392,14 g. La solution de sel de Mohr est préparée au départ telle que 1 mL de solution réduise 0,5 mL de solution de dichromate. Soit 134,4 g/L c'est à dire environ 0,343 mol/L. Attention là encore aux dangers liés à la manipulation d'acide sulfurique concentré puis d’un mélange sulfochromique. Il faut absolument avoir été formé et respecter les procédures et instruction de sécurité et de gestion des déchets nécessaires. Gérer les déchets dans le respect de l'environnement. |
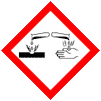
Données de sécurité concernant le dichromate de potassium, poudre pure |
||
|
Matières solides comburantes (Catégorie 2)
Cancérogénicité (Catégorie 1B) Mutagénicité sur les cellules germinales (Catégorie 1B) Toxicité pour la reproduction (Catégorie 1B) Toxicité aiguë, Inhalation (Catégorie 2) Toxicité aiguë, Oral(e) (Catégorie 3) Toxicité spécifique pour certains organes cibles - exposition répétée (Catégorie 1) Toxicité aiguë, Dermale (Catégorie 4) Corrosion cutanée (Catégorie 1B) Sensibilisation respiratoire (Catégorie 1) Sensibilisation cutanée (Catégorie 1) Toxicité aiguë pour le milieu aquatique (Catégorie 1) Toxicité chronique pour le milieu aquatique (Catégorie 1) |
Mention de danger H272; H301; H312; H314; H317; H330; H334; H340; H350; H360; H372; H410 Conseils de prudence P201; P220; P260; P273; P280; P284 |
Compte tenu de la non volatilité du dichromate de potassium et du règlement CE N 1272/2008 ( http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2008:353:0001:1355:FR:PDF ), notamment l'annexe 6 page 415, et de la FDS pour du dichromate en solution à 0,1 mol/L proposée par le revendeur Ward’s science (Canada), la solution de dichromate de potassium à 33,604 g/L (soit 24,7 g/L en chromate) sera donnée aux risques comme indiqué dans l'image ci-dessous :

L'élimination implique une filière déchets adaptée et conforme.
Pour l'essai, on peut écrire :
ndi,départ |
= |
ndi,eth |
+ |
ndi,fe2+ |
nombre de moles de dichromate introduites au départ
|
|
nombre de moles de dichromate qui vont réagir avec
l'éthanol |
|
nombre de moles de dichromate reliquatqui va être
dosé par le sel de Mohr |
Ce qui conduit après utilisation des stoechiométries de réactions à :
nombre de moles d'éthanol dans E' = Cdichr*U - 1/6 Cfe2 * VE
Mais le témoin négatif donne la relation Cfe2 = 6 Cdichr*U / VT (où VT désigne la chute de burette pour le témoin)
Et l'éthanol présent dans E' provient d'une fiole jaugée de volume Vfj contenant tout l'éthanol qui était présent dans le volume E d'échantillon de départ à doser de concentration Ceth en éthanol.
D'où la relation :

On peut évidemment préférer des expressions en concentration massique où en %(v/v). Il convient alors d'utliser la masse molaire de l'éthanol Meth = 46,0684 g/mol ainsi que sa masse volumique à une température de référence de 20°C ρeth= 0,78934 g/mL. On obtient alors les 2 formules :

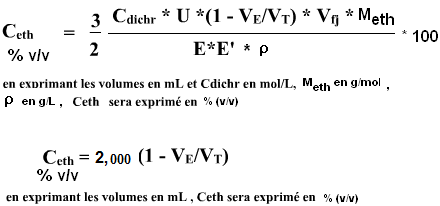
Pour information, Selon l'OIV (Organisation Internationale de la vigne et du Vin), « le titre alcoométrique volumique d'un vin est égal au nombre de litres d'éthanol contenu dans 100 litres de vin, ces volumes étant tous deux mesurés à la température de 20°C. Son symbole est «% vol». Le titre alcoométrique volumique du vin est déterminé ainsi : le vin est alcalinisé, distillé et le titre alcoométrique est déterminé par mesure physique de masse volumique (pycnomètre, résonateur à réflexion …). « Les homologues de l'éthanol, ainsi que l'éthanol et les homologues de l'éthanol engagés dans des esters, sont compris dans le titre alcoométrique, car ils se retrouvent dans le distillat ».
Si l'alcool d'un distillat peut être mesuré par la méthode chimique d'oxydation par le dichromate, cette méthode est réservée aux liquides faiblement alcoolisées (dont le vinaigre) et aux moûts. Le mode opératoire ci-dessus est une adaptation du mode opératoire pour déterminer l'alcool résiduel des vinaigres pour mesurer des boissons de type panaché. Réglementairement, la dénomination "panaché" est réservée à la boisson présentant un titre alcoométrique supérieur à 0,5% vol et inférieur ou égal à 1,2% vol. et exclusivement constituée d’un mélange de bière et de boisson gazeuse aromatisée sans alcool.
Voici enfin les références bibliographiques qui ont été utilisées pour écrire ces pages (liens internet valides le 6/01/2018)
:
• Dans le "Recueil des méthodes d'analyse des vinaigres de vin" de l'OIV (Organisation Internationale de la vigne et du Vin)
la fiche OENO 56/2000 (dosage de l'éthanol résiduel du vinaigre). Accessible à :
http://www.oiv.int/public/medias/2701/oeno-56-2000.pdf . Le mode opératoire proposé ci-dessus est une adaptation de OENO 56/2000 qui utilise
notamment des volumes de solutions de dichromate différents, un indicateur redox pour le dosage en retour différent ... Je vous invite à consulter la fiche OENO 56/2000 !
Et détail qui peut avoir son importance : la fiche OENO 56/2000 donne des indications de répétabilité et reproductibilité.
• Dans le "Recueil des méthodes internationales d'analyse des vins et des moûts (2 vol.)" de l'OIV
http://www.oiv.int/fr/normes-et-documents-techniques/methodes-danalyse/recueil-des-methodes-internationales-danalyse-des-vins-et-des-mouts-2-vol,
on trouvera évidemment les méthodes de dosage de l'éthanol des vins (distillation puis mesure de masse volumique du distillat. Différentes possibilités proposées).
Il suffit de consulter les 2 références OIV (
http://www.oiv.int/public/medias/5154/oiv-ma-as312-01a.pdf et
http://www.oiv.int/public/medias/2339/oiv-ma-as312-01b.pdf)
.
• Gonzalez-Rodrigez, Perez-Juan, Luque de Castro, two parameter determination in vineager by a flow injection-pervaporation system, Analyst, 2001.