Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2003/2018
[A propos de l'auteur]
[Droits de copie]
![]()
Deux supports poreux - qui seront imprégnés d'un électrolyte de pH tamponné - sont actuellement utilisés pour les électrophorèses de zone des acides nucléiques :
• les gels de polyacrylamide ;
• les gels d'agarose.
A cause de la présence des résidus phosphates estérifiés - à chaque base azotée son phosphate estérifié en 3' et 5' du désoxyribose - on peut considérer que l'ADN bicaténaire linéarisé est un polyélectrolyte uniformément chargé négativement (1 charge négative par base azotée aux pH de travail en laboratoire). Conséquence, en milieu liquide, des fragments d'ADN bicaténaire linéaires ont tous la même mobilité électrophorétique quelle que soit leur taille. Ils ne sont pas séparés lors d'une électrophorèse dans un "univers" simplement liquide. En revanche, si on réalise une électrophorèse en milieu liquide imprégnant un gel poreux, les effets de tamisage liés à la présence des mailles du gel vont permettre de séparer des fragments linéaires d'ADN par électrophorèse de zones : les petits fragments seront moins impactés par l'effet de tamisage moléculaire et migreront plus vite que les plus gros fragments.
Les gels d'agarose sont utilisés pour séparer des fragments de quelques centaines à 20 000 paires de bases.
Les électrophorèses en gel d'agarose sont réalisées en gels horizontaux immergés (sous environ 1 mm de tampon, guère plus sinon l'essentiel du courant passera par la couche au dessus du gel et pas par le gel ...).
Les révélations, classiquement réalisées avec du bromure d'ethidium (un agent intercalant qui fluoresce peu à l'état libre et fortement une fois intercalé, excitation U.V., émission orange) sont plutôt réalisées aujourd'hui avec des substituts fluorescents beaucoup moins toxiques (molécules se liant à l'ADN bicaténaires par exemple, peu fluorescentes à l'état libre et fortement fluorescentes une fois liées, excitation dans le bleu, fluorescence verte).
1.1(i)) Le problème de l'apparition des courants de convection.
Qui dit électrophorèse dit intensité de courant et donc effet Joule, production de chaleur. Le dégagement de chaleur se traduit
par l'apparition de courants liquidiens de convection au sein du support poreux. Ces courants élargissent
les zones de séparation : le pouvoir séparatif est diminué ! Trop de chaleur et l'agarose peut fondre !
Pour minimiser ce phénomène, on travaille sous des intensités de courant pas trop élevées
et on peut réfrigérer .
On verra plus loin que les techniques en électrophorèse capillaire permettent une extraction très élevée de la chaleur produite
sous des champs appliqués très importants. Les convections sont ainsi minimisées et la résolution est très élevée...
1.1(ii) Les supports chargés qui conduisent à de l'électroendosmose.
Certains agaroses commercialisés pas totalement désulfatés portent des groupements à charge négative. De tels supports entraînent l'apparition d'un courant liquidien : du pôle positif au pôle négatif dans ce cas de support à charges négatives. Ce courant liquidien est lié à la migration électrophorétique des contre-ions du support qui entraînent le solvant par effet d'osmose : on parle électroendosmose liée au support. L'électroendosmose liée à un agarose chargé de mauvaise qualité donne des migrations anormalement ralenties. Faut donc travailler avec des agaroses non chargés "qualité biologie moléculaire"... |
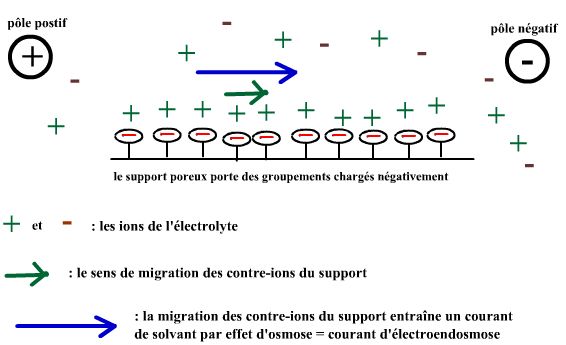 |
Comme le montre le schéma, dans le cas d'un support chargé négativement (le cas classique), le courant d'électroendosmose est dirigé du pôle positif vers le pôle négatif : il s'oppose à la migration électrophorétique des particules chargées négativement et augmente la vitesse de migration des particules chargées positivement. |
La migration des formes plasmidiques non linéarisées n'est évidemment pas conforme au profil de migration des formes linéaires. Pour un ADN plasmidique bicaténaire il existe les formes naturelles circulaires à supertours négatifs (supercoiled covalently closed circular, ccc), elles sont très compactes. Il existe la forme à coupure unique monobrin qui prend une conformation relachée (forme ouverte relachée, open circular relaxed, oc), elle est peu compacte. Si le plasmide subit une coupure unique double brin, on obtient la forme linéarisée (linear plasmid DNA, lDNA). Classiquement la forme ccc est plus mobile que la forme linéarisée plus mobile que la forme oc.
Voici une illustration :
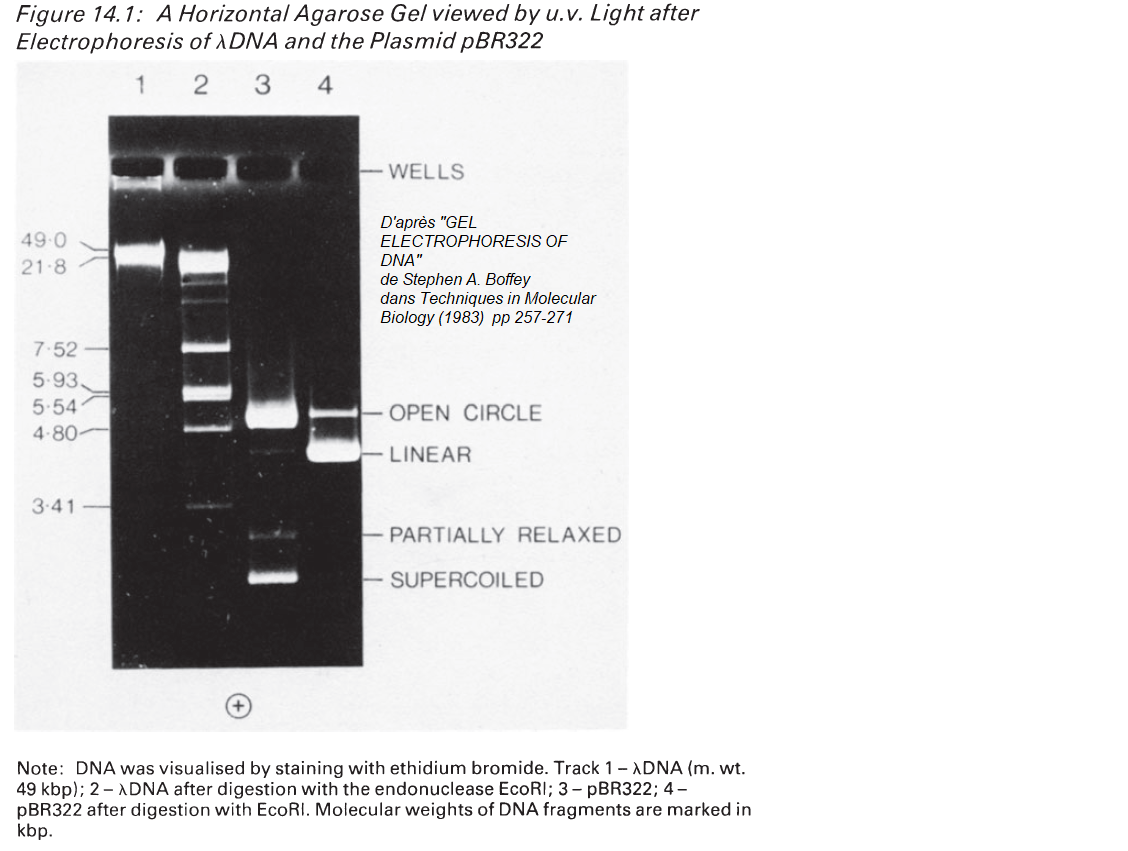
Au delà de 20 kpb les migrations classiques en gel d'agarose ne sont plus résolutives. Les molécules d'ADN migrent à peu près toutes à la même
vitesse. Cet effet vient du fait que lorsque les molécules d'ADN sont très grandes, plus grandes que la taille des pores qui séparent les fibres du gel, elles
se positionnent dans le gel sous une forme très complexe : pour une part comme un
long serpent faufilé au hasard dans le réseau, pour une part un peu comme une chenille (ou un accordéon) étirée sur une fraction de sa longueur ou rassemblée de façon très compacte ailleurs.
En absence de champ électrique, globalement la forme de "faufilage" sera sphérique. Seules les deux extrémités
ont suffisamment de liberté pour "gigoter". Sous l'effet d'un champ électrique une des deux extrémités va orienter le chemin, tirer le reste de la molécule qui va
s'étirer par endroits, plus ou moins ramper, plus ou moins se re-condenser puis verra une des deux extrémités orienter à nouveau le chemin... ça migre de façon très complexe mais indépendante de la taille.
Dans la suite on va appeler ça une "reptation-chenillée".
L'électrophorèse en champ pulsé (Pulsed-field gel electrophoresis (PFGE)) va permettre de s'affranchir de la limite des 20 kpb.
Les molécules d'ADN sont soumises à des champs électriques appliqués alternativement dans 2 directions. Avant de pouvoir migrer dans chaque nouvelle direction
du champ par "reptation-chenillée" chaque molécule doit se réorienter. Et cette réorientation (qui commence par les extrémités) dépend de la taille,
elle plus rapide pour les moins grandes molécules. Si la durée de chaque alternance est convenablement choisie (condition fondamentale !!),
la technique redevient ainsi séparative grâce aux champs électriques alternés.
Note. Pour ceux que la "reptation-chenillée" intéresserait beaucoup, il y a l'excellent article de revue "Carlos Bustamante, Sergio Gurrieri, Steven B. Smith, Towards a molecular description of pulsed-field gel electrophoresis, Trends in Biotechnology, Volume 11, Issue 1, 1993, Pages 23-30". Pour ceux qui n'arrivent pas à l'obtenir et qui aiment le visuel, vous pouvez ouvrir un fenêtre montrant une série d'images extraites de l'article par un petit clic sur ce lien".
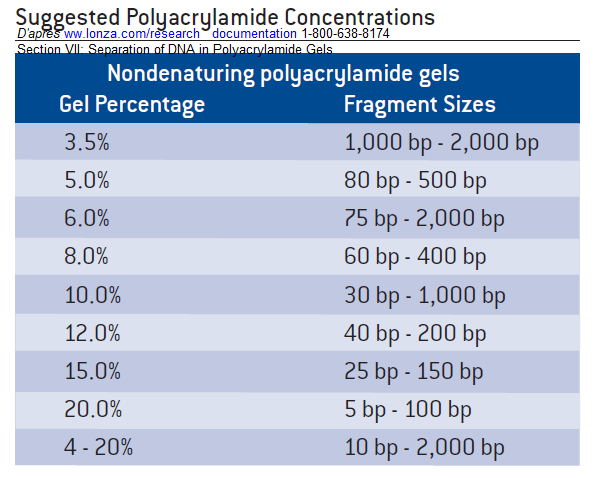
Les gels de polyacrylamide permettent d'obtenir des mailles très serrés et sont utilisés dans le domaine de quelques paires de bases à quelques centaines de paires de base pour les ADN double brins en conditions natives. Un domaine d'utilisation finalement assez rare pour des ADN double brins. Les gels de polyacrylamide sont surtout utilisés lors d'analyses particulières en conditions dénaturantes pour purifier des oligonucléotides simples brins, ou en séquençage, ou en DNAfootprinting ou même lors d'analyses non dénaturantes en gel-shift assays (étude d'interactions séquence nucléique protéine). Mais ceci sort du cadre de ce chapitre ...