Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2007/2015
[A propos de l'auteur]
[Droits de copie]
La spectrométrie d’absorption moléculaire est une technique applicable à l’analyse qualitative et à l’analyse quantitative qui permet le mesurage de la concentration d’un composé dissous dans une solution. Elle s’effectue pour des éclairements dans le domaine du proche UV, du visible et du proche infrarouge, ce qui correspond à l’intervalle 180 - 1000 nm en longueur d’onde.
Soit un faisceau de radiations monochromatiques
parallèles de puissance radiante incidente Pi qui traverse, sous
incidence normale, un milieu absorbant à faces planes et
parallèles, homogène et isotrope, non luminescent et
non diffusant, avec un parcours optique l.
La puissance radiante transmise décroît
exponentiellement selon la longueur du parcours optique et quand
augmente la concentration c du composé absorbant (du moins
tant que c n’est pas trop élevé).
Note importante: la loi est une loi limite à "dilution infinie et interactions nulles". La linéarité est perdue aux concentrations élevées (absorbances élevées). La tolérance de non linéarité sera à établir au cas par cas par l'utilisateur pour chacun de ses couples instrument/substance.
En utilisant une écriture mettant en jeu les puissances de 10, la loi peut donc s’écrire :
$$P_t=P_i 10^{-\varepsilon lc}$$
avec Pt :
intensité radiante transmise, Pi : intensité radiante incidente, l : longueur
du trajet optique, c : concentration du composé absorbant,
ε coefficient lié à la substance absorbante
dans les conditions de l’expérience ( ε dépend de la nature du
composé absorbant, de la longueur d’onde, de la nature
du solvant, de la température).
ε est le plus souvent
appelé coefficient spécifique d’absorption pour
le composé absorbant dans les conditions
expérimentales. On trouve aussi le mot
coefficient spécifique d’extinction et bien d'autres.
La transmittance τ (ou facteur de
transmission) est définie par \(T = \frac {P_t}{P_i}\)
L’absorbance A est
définie par \(A =\log_{10} \left ( \frac{P_i}{P_t} \right )\)
et on peut donc exprimer la loi de Lambert-Bouguer et Beer
par la fameuse relation A = ε l c
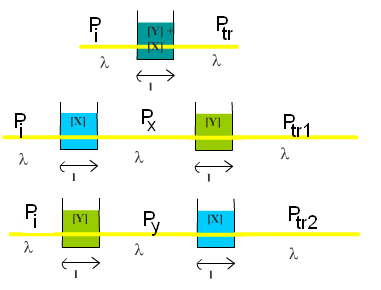 |
Avec les résultats suivants : Ptr1 = Ptr2 = Ptr A = Log(Pi / Ptr) = εX l [X] + εY l [Y] |
Note importante. La loi d'additivité est fondamentale pour comprendre le fonctionnement des spectrophotomètres. L'absorbance d'une solution sera toujours mesurée contre une solution de référence ! Ce qui signifie que toute mesure d'absorbance est en réalité la mesure d'une différence entre l'essai à mesurer et une solution de référence. A méditer et à garder en tête !
Les puissances radiantes (souvent appelées flux lumineux)
sont exprimés en watts (symbole W) (1W = 1 J/s).
L'absorbance est une grandeur sans unité.
La question de la grandeur et des unité pour le coefficient d'absorbance
spécifique ε est plus complexe :
- Pour une expression avec une concentration molaire du
composé absorbant dissous, on parle du coefficient
(spécifique) d'absorption (ou d'absorbance)) molaire, en
"longueur-1.mol-1.volume". L'unité
sera le m2.mol-1 ou plus usuellement le
cm-1.mol-1.l ou ...
- Pour une expression avec une concentration massique du
composé absorbant dissous, on parle généralement du coefficient
(spécifique) d'absorption (ou d'absorbance) massique, en
"longueur-1.masse-1.volume". L'unité
sera le m2.kg-1 ou plus usuellement le
cm-1.g-1.l ou ...