Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour sept. 2016
[A propos de l'auteur]
[Droits de copie]
De nombreux phénomènes et réactions du vivant requérant de l'énergie (le ΔG de la réaction est a priori >0) ne sont possibles que parce qu'ils sont couplés à l'hydrolyse de l'ATP en ADP+Pi ou à l'hydrolyse de l'ATP en AMP + PPi.
Pi et PPi = phosphate et pyrophosphate respectivement.
Si on écrit l'ATP Ap~p~p, l'ADP Ap~p, l'AMP Ap où ~ désigne les liaisons phosphoanhydrides et p les groupements phosphates et si Pi désigne un ion phosphate :
Ap~p~p + H2O --> Ap~p + Pi c'est à dire ATP + H2O --> ADP + Pi ; ΔG0' = -30,5 kJ/mol
Ap~p~p + H2O --> Ap + PPi c'est à dire AMP + H2O --> AMP + PPi ; ΔG0' = -32,2 kJ/mol
En pratique dans les conditions cellulaires, compte-tenu des concentrations usuelles en ATP, ADP, Pi, \( \Delta G_{hydrolyse ATP} = \Delta G^{0'} + RT \ln \frac {[ADP]\cdot[Pi]}{[ATP]} = -45~à~-60~~kJ/mol \).
Pour dire que l'enthalpie libre d'hydrolyse des liaisons phosphoanhydrides est très négative, les expressions suivantes sont équivalentes : les liaisons phosphoanhydrides de l'ATP sont à haut potentiel d'hydrolyse ou les liaisons phosphoanhydrides de l'ATP sont riches en énergie ou l''ATP est riche en énergie.
Soit B + C --> D à réaliser avec ΔG>0 , donc impossibilité thermodynamique. Un couplage utilisant l'énergie de l'ATP sera par exemple:
|
\( B + Ap \thicksim p \thicksim p \longrightarrow B \thicksim p + Ap\thicksim p \) |
"L'énergie de liaison phosphoanhydride a été transférée de l'ATP vers B". |
|
\( B \thicksim p + C \longrightarrow D + P_i + H_2 O \) |
B~p est réactif avec C pour donner D + Pi. ΔG < 0 |
Le bilan des 2 réactions est : |
\( B + C + Ap \thicksim p \thicksim p \longrightarrow D + Ap\thicksim p + P_i + H_2 O \) |
On a bien rendu le "job" à réaliser possible (chaque réaction a un ΔG < 0) et cela " a couté" l'équivalent d'un ATP devenu ADP et Pi |
Attention, même si le bilan du couplage donne l'impression que de l'ATP a été hydrolysé, jamais l'ATP n' a été directement hydrolysé (ATP + H2O --> ADP + Pi) car cela n'aurait "servi à rien" ; sans couplage l'énergie aurait été perdue en chaleur. Il a fallu un chemin particulier avec couplage pour que l'ATP puisse transférer l'énergie libre de sa fonction phosphoanhydride vers la réalisation de D à partir de B et C. Une expression consacrée en biologie est de dire que la transformation B + C --> D est couplée à l'hydrolyse de l'ATP. On voit bien que c'est un abus de langage, mais il est autorisé... |
||
On ne peut manquer la très célèbre réaction d'assimilation de l'N de NH4+ depuis le glutamate vers la glutamine :
\( Glutamate + NH_4^+ + ATP \longrightarrow glutamine + ADP + P_i \)
-----------------------------------------
La biosynthèse des protéines à partir des acides aminés (traduction) est un très gros poste de consommation de l'énergie libre ATP.
Le ΔG de la formation d'une liaison peptidique est positif (la tendance est à l'hydrolyse), les acides aminés doivent être activés. Cela se passe au niveau des ARNt avec des enzymes clés, les aminoacyl-tRNA synthétases.
$$ aminoacide + Ap \thicksim p \thicksim p \longrightarrow Ap \thicksim aminoacide + p \thicksim p $$ $$ Ap \thicksim aminoacide + ARNt \longrightarrow ARNt \thicksim aminoacide $$L'acide aminé ainsi activé sur l'ARNt (qui porte l'anticodon qui lui correspond) est désormais réactif pour former une liaison peptidique au niveau d'un ribosome. Au niveau du ribosome, la traduction coûte aussi beaucoup "d'énergie libre". Mais les couplages énergétiques se font non pas avec de l'ATP mais du GTP (Gp~p~p) qui libère ainsi du GDP et du Pi. Un GTP est donneur d'énergie libre pour l'incorporation d'un ARNt~aminoacide dans le site acide aminé du ribosome. Un autre GTP est donneur d'énergie libre pour la translocation du peptidyl-ARNt du site acide aminé au site peptidique du ribosome...
GTP -> GDP + Pi est équivalent à ATP -> ADP + Pi car la nucléoside-diphosphate kinase catalyse la réaction ATP + GDP <=> ADP + GTP.
------------------------------------------
De nombreux transports actifs utilisent "l'énergie libre anhydride d'acide de l'ATP"
Un schéma de principe de couplage entre un passage membranaire de substrat S contre son gradient d'énergie et l'hydrolyse de l'ATP en ADP serait :

Il existe de multiples formes de ces transports actifs qui utilisent "l'énergie libre de l'ATP" : les pompes ATPasiques, les systèmes de transport dits ABC (ATP Binding cassette, très fréquents chez les bactéries pour exporter mais aussi pour des importations).
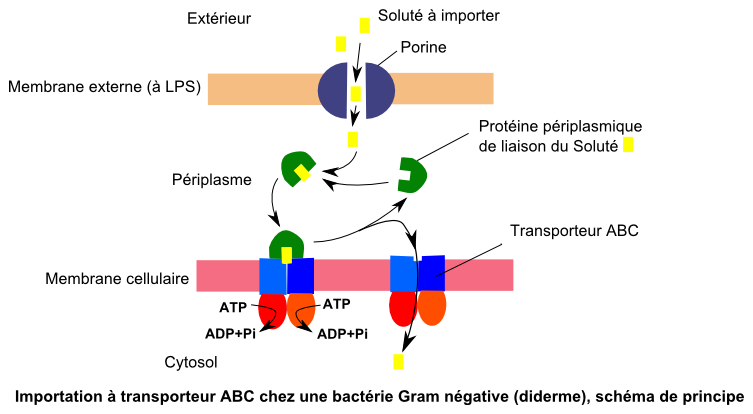
Dans les paragraphes qui précèdent, on a vu 3 types de couplages énergétiques qui "consomment" la monaie énergétique : ceux qui ont dans leur bilan ATP -> ADP + Pi (les plus courants) et ceux qui proposent GTP -> GDP + Pi ou ATP -> AMP + PPi.
Des réactions enzymatiques font qu'il suffit à une cellule de régénérer l'ATP à partit d'ADP et Pi pour faire face. En effet on trouve les réactions cellulaires suivantes :
- La nucléoside-diphosphate kinase catalyse la réaction ATP + GDP < => ADP + GTP. Ainsi régénérer l'ATP à partit d'ADP et Pi permet de régénérer GTP à partir du GDP.
- L'adénylate kinase catalyse la réaction AMP + ATP < => ADP + ADP. La pyrophosphatase catalyse PPi -> 2 Pi (irréversible). Ainsi régénérer l'ATP à partit d'ADP et Pi permet de régénérer l'ATP à partir de l'AMP. On remarquera qu'en bilan, ATP -> AMP + PPi est énergétiquement équivalent à 2 ATP -> 2 ADP + 2 Pi.
Il existe 3 grands types de mécanismes qui permettent au vivant de régénérer l'ATP à partir d'ADP + Pi :
• La phosphorylation au niveau du substrat (procédé quasi unique chez les chimiorganotrophes fermemtatifs obligatoires);
• La phosphorylation oxydative (la spécialité des organismes qui respirent);
• La photophosphorylation (la spécialité des phototrophes).
Ces 3 mécanismes font l'objet de chapitres dédiés. On peut cependant signaler que phosphorylation oxydative et photophosphorylation passent par un gradient protonmoteur transmembranaire exploité par les ATPsynthases pour régénérer l'ATP.