Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2003/2020
[A propos de l'auteur]
[Droits de copie]
![]()
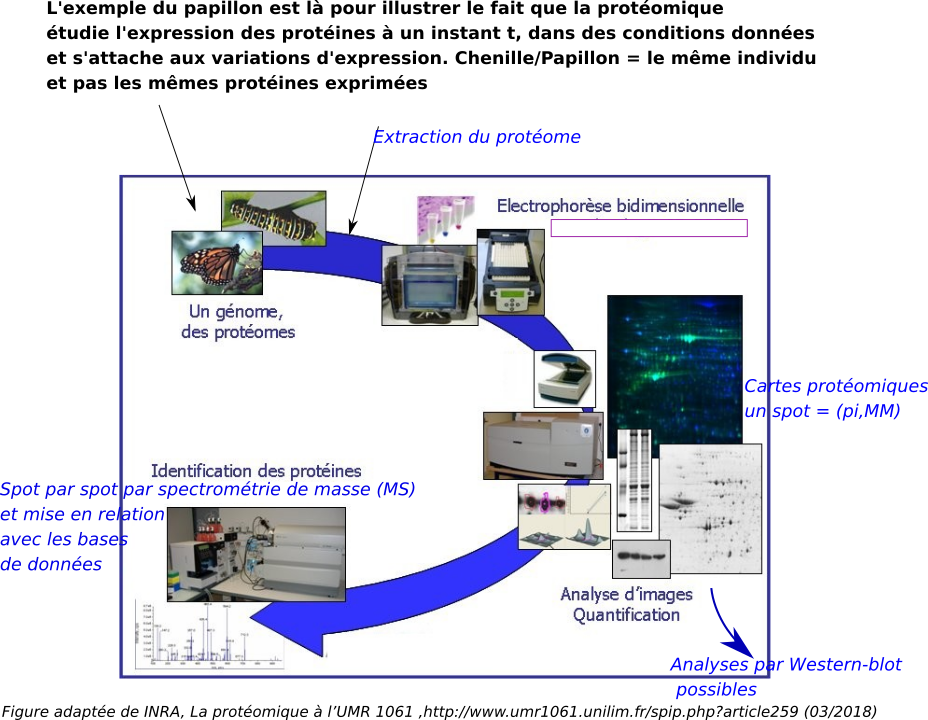
L'électrophorèse bidimensionnelle (2D) des protéines dénaturées (EBD) est, comme son nom l'indique, une combinaison de deux électrophorèses. La première, une isoélectrofocalisation (IEF), sépare les polypeptide selon leurs différents points isoélectriques (pi). La deuxième, une électrophorèse en présence de dodécyl sulfate de sodium (SDS), sépare en fonction des masses moléculaires (MM). Ces deux électrophorèses, perpendiculaires l'une par rapport à l'autre, combinent deux critères indépendants, pi et MM. C'est ce qui rend cette technique particulièrement résolutive.
Plusieurs centaines des constituants d'un mélange de polypeptides peuvent être individualisés sous forme de spots sur un gel. Les applications sont multiples, depuis la vérification de la pureté d'un échantillon jusqu'à la protéomique. La proténomique désigne la science qui étudie les protéomes, c’est-à-dire l’ensemble des protéines d’une cellule, organite, tissu, organe ou organisme à un moment donné et sous des conditions données (variations d'expression en fonction de la variabilité génétique, suivi des variations d'expression en fonction de différents facteurs : stade de développement, différenciation, traitements (drogues, stress, hormones, etc)). Ce terme a été utilisé pour la première fois dans une publication scientifique en 1997 par P. James. Il le dérive de protéome, terme inventé en 1995. La protéomique est au protéome, ce que la génomique est au génome.
Un préalable pas si simple, L'extraction des protéines (attention aux artefacts ...). Les protéines vont être analysées à l'état dénaturé et la solubilité doit être maximisée, afin de favoriser leur entrée dans le gel. Il faut évidemment veiller à conserver l'intégrité des polypeptides : éviter toute interaction avec d'autres molécules qui modifieraient leur pI (carbamylations, complexation avec des phénols...), les dégraderaient (protéases), tendraient à les faire précipiter (quinones) ou à perturber l'électrophorèse (chlorophylle, lipides, acides nucléiques, sels en excès, acidité). L'élimination de composants indésirables et la concentration en protéines peuvent être réalisées par précipitation (TCA, acétone,...) et reprise des protéines dans un tampon en général très proche de celui préconisé par O'Farrel (tampon avec urée 9 M + réducteur non ionique + détergent non ionique type NP40).
Pour comprendre par l'exemple, se rendre à : http://www.seed-proteome.com/index.php?rub=Seed_germination_proteins_2
Un bon exemple, un peu plus ancien à : http://www.ibgc.u-bordeaux2.fr/YPM/carte.htm