Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2007/2017
[A propos de l'auteur]
[Droits de copie]
![]()
On suppose qu'on étudie une molécule X dans un solvant homogène non diffusant et non absorbant du rayonnement électromagnétique étudié. On suppose les phénomènes de diffusion nuls (du moins négligeables, ce qui est le cas avec des solutions limpides).
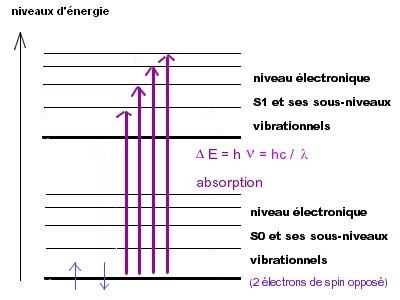 |
• Aux λ U.V. et visibles, l'énergie des photons peut être suffisante pour entraîner des transitions entre niveaux électroniques de liaison chez de nombreuses molécules organiques (ou minérales). Evidemment, il y aura également modification des états vibrationnels et rotationnels qui apparaissent comme structure fine des niveaux électroniques. • Sur le schéma, le niveau de départ est le niveau de plus basse énergie du niveau S0. En effet, aux températures ambiantes, c'est l'état ultramajoritaire (les sous-niveaux vibrationnels et rotationnels d'énergie un peu plus élevée sont rarement occupés). • Comme les niveaux vibrationnels et rotationnels sont multiples et du fait de facteurs physiques complexes d'élargissement (chocs avec le solvant, effets Doppler ...), les spectres d'absorption moléculaire sont des spectres de bandes (à l'opposé des spectres de raies atomiques). Donc le schéma de gauche est à lire avec un regard critique : il donne la mauvaise impression d'une zone de raies d'absorption ! • Pour information : la durée de l'absorption d'un photon est d'environ 10-15 s. |
 |
. |
|
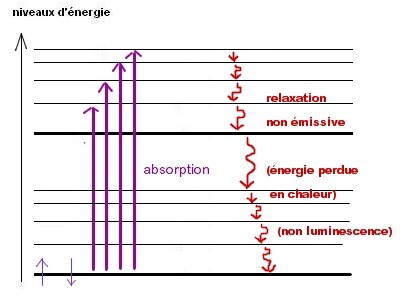
En absence de phénomène de
luminescence (c'est à dire en absence de fluorescence
et phophorescence), l'énergie absorbée sera rendue au
système sous forme de chaleur : |
 |
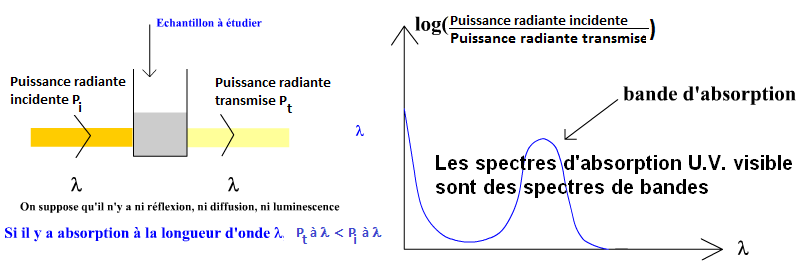
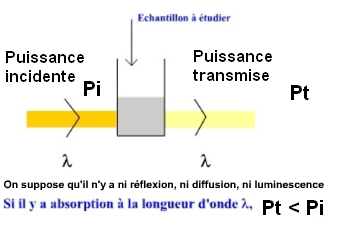
On peut mesurer quantitativement le phénomène d'absorbance. La loi de Lambert-Bouguer et Beer donne une relation quantitative fondamentale applicable aux faibles concentrations (plus la concentration s'élève plus on s'écarte de la loi).
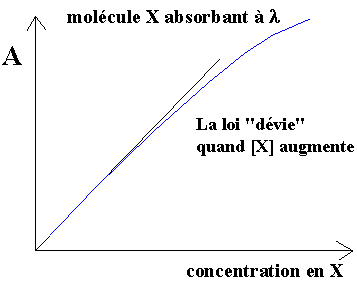 |
• Soit un faisceau de radiations monochromatiques parallèles de puissance radiante incidente Pi qui traverse, sous incidence normale, un milieu absorbant à faces planes et parallèles, homogène et isotrope, non luminescent et non diffusant, avec un parcours optique l. La puissance radiante transmise Pt décroît exponentiellement selon la longueur du parcours optique et quand augmente la concentration c du composé absorbant (du moins tant que c n’est pas trop élevé). $$ P_t = P_i~10^{-\epsilon ~ l ~ c} $$avec Pt : puissance radiante transmise (flux transmis), Pi : puissance radiante incidente (flux incident), l : longueur du trajet optique, c : concentration du composé absorbant, ε coefficient dans les conditions de l’expérience (ε dépend de la nature du composé absorbant, de la longueur d’onde, de la nature du solvant, de la température). ε est appelé coefficient spécifique d’absorbance pour le composé absorbant dans les conditions expérimentales. On peut aussi utiliser le mot coefficient spécifique d’extinction. • L’absorbance A est définie par $$ A = Log_{10} \left( \frac {P_i}{P_t} \right) $$et on peut donc exprimer la loi de Lambert-Bouguer et Beer par : $$ A = \epsilon l c $$Avec propriété d'additivité de la loi (Voir Présentation complète loi de Beer-Lambert )• Les flux lumineux sont exprimés en watts (symbole W). • L'absorbance est une grandeur sans unité. |
Note : La loi de Beer-Lambert est une "loi idéale à interactions nulles et dilution infinie" : plus la concentration est élevée plus la loi est déviée. Et, cerise sur le gâteau, certains appareillages fabriquent de la non linéarité quand les concentrations s'élèvent à cause, par exemple, de leur fond de lumière parasite... A chacun d'être très pragmatique quant au niveau de "non linéarité" qu'il tolère ...Pour plus de détails, voir beerlambertloi_1.php.
Voir le chapitre dédié " Les spectrophotomètres pour mesures de l'absorption moléculaire U.V. et visible de solutions ".
L'absorbance provient de groupements chimiques appelés chromophores. Ci-dessous un tableau présentant les chromophores. On remarquera que les chromophores sont à électrons π ou à doublets libres (n). On remarquera l'absence de C-OH (faudrait travailler vers 160 nm pour voir une absorption, dans le vide) : donc entre 200 et 800 nm, les alcools et l'eau feront de bons solvants car ils n'absorbent pas. On remarquera enfin que les λ proposées sont situées dans l'U.V. vers 200-250 nm. Or on va trouver de nombreuses molécules absorbant dans l'U.V. très proche ou le visible. Ce déplacement vers les longueurs d'onde élevées (donc des sauts moins énergétiques) est présent dans les molécules à électrons π et/ou n conjugués.
|
Tableau repris de
http://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/Spectrpy/UV-Vis/spectrum.htm#uv1. Il apparaît clairement que les chromophores sont des groupements avec liaison Π et/ou doublets n et que tout ça absorbe dans l'UV avec des ε souvent assez faibles. On remarquera l'absence de C-OH (faudrait travailler vers 160 nm pour voir une absorption, dans le vide) : donc entre 200 et 800 nm, les alcools et l'eau feront de bons solvants car ils n'absorbent pas. |
|
La figure ci-dessous reprise de http://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/Spectrpy/UV-Vis/spectrum.htm#uv1 montre bien l'effet de déplacement vers des λ plus élevées et vers des absorbances plus élevées du à la conjugaison des électrons Π (effet bathochromique et hyperchromique respectivement). 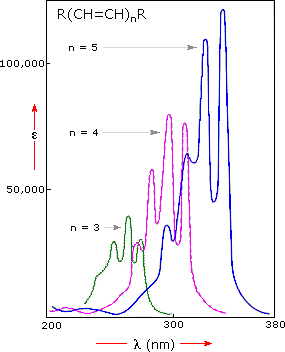
Les spectres peuvent présenter des bandes fines qui correspondent à différents niveaux rotationnels et à différentes conformations ... mais là, ça devient délicat ... |
On va pouvoir ainsi aller vers des molécules qui absorbent dans le visible, des molécules colorées quoi !
|
Pour en savoir plus, je vous invite à consulter le très bon site http://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/Spectrpy/UV-Vis/spectrum.htm#uv1 par William Reusch, Dept. of Chemistry, Michigan State University. Merci à lui pour l'autorisation de publication des schémas.
Note. Pour ceux qui aiment le vocabulaire. On parle d'effet bathochrome pour qualifier un déplacement d'absorbance vers des longueurs d'ondes plus élevées. On parle d'effet hypsochrome pour qualifier un déplacement d'absorbance vers des longueurs d'ondes plus courtes. On parle d'effet hyperchrome pour qualifier un effet d'augmentation de l'absorbance. On parle d'effet hypochrome pour qualifier un effet de diminution de l'absorbance.
Voici la couleur perçue pour les longueurs d'ondes respectives :
Violet: 400 - 420 nm
Indigo: 420 - 440 nm
Bleu franc: 440 - 490 nm
Vert: 490 - 570 nm
Jaune : 570 - 585 nm
Orange: 585 - 620 nm
Rouge : 620 - 780 nm
La couleur blanche est due à la présence "équilibrée" en puissance de toutes les longueurs d'onde de 400 à 800 nm.
Si, éclairé en lumière blanche, une solution vous apparaît bleue, c'est qu'elle absorbe le rouge.
Si, éclairé en lumière blanche, une solution vous apparaît rouge, c'est qu'elle absorbe le bleu.
Le vert est un peu spécial, on peut créer l'effet en absorbant côté 400-500 nm et côté 500-800 nm.