Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2007/2017
[A propos de l'auteur]
[Droits de copie]
![]()
On suppose qu'on étudie une molécule X dans un solvant homogène non diffusant et non absorbant du rayonnement électromagnétique étudié. On suppose les phénomènes de diffusion nuls, en tous cas on les ignore (ce qui implique des solutions limpides).
La fluorescence est un phénomène de luminescence. La luminescence désigne la propriété que vont avoir certaines molécules d'émettre des photons lors de leur désexcitation depuis un état électronique excité. L'état excité peut avoir été obtenu par absorption d'une radiation électromagnétique (on parlera de photoluminescence) ou par voie chimique (on parlera de chimioluminescence) ou même par voie mécanique (par friction par exemple).
En photoluminescence, l'excitation est d'origine électromagnétique : très souvent U.V. , parfois dans le visible. On distingue la fluorescence et la phosphorescence (voir le paragraphe dédié à la phosphorescence).
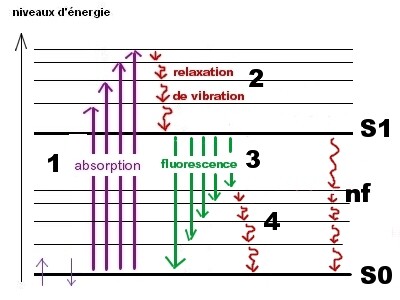 |
Le diagramme dit de Jablonski qui est présenté à gauche permet de définir la fluorescence. On retiendra la propriété fondamentale : S0 : état électronique fondamental (en traits moins épais les sous-niveaux vibrationnels) S1 : état électronique excité (en traits moins épais les sous-niveaux vibrationnels) |
|
En 1 : phénomènes d'absorption : passages à un état électronique excité (10-15s), différents niveaux vibrationnels et rotationnels sont accessibles. En 2 : relaxations vibrationnelles (10-12s) : retour sur le niveau de plus basse énergie de l'état excité. Conversion de l'énergie en chaleur. En 3 : la fluorescence. Quand il y a fluorescence, c'est quand le retour au niveau électronique fondamental est réalisé avec émission d'un photon. La durée de vie de l'état excité est classiquement de l'ordre de 10-8s chez un fluorochrome standard. Conclusion : la fluorescence "est immédiate à l'absorption pour des observations standards" et le photon émis est moins énergétique que le photon absorbé. Ainsi la λ émise est plus longue que la λ absorbée. En 4 : relaxations vibrationnelles (10-12s) : retour sur le niveau de plus basse énergie de l'état fondamental. Conversion de l'énergie en chaleur. En nf : la fluorescence est en compétition avec les désexcitations non émissives. Par conversion intersystème (comme on
l'a vu lors des absorptions non suivies de luminescence) ou par Quenching avec une autre molécule (voir plus loin). | |
Note : le diagramme présente une fluorescence S1/S0 mais il existe des cas plus complexes. Vous pouvez ouvrir une nouvelle fenêtre qui propose un encadré : "pour en savoir plus" . A méditer : "le mieux est parfois l'ennemi du bien."
Voici un schéma de principe (et absolument pas un schéma technique) :
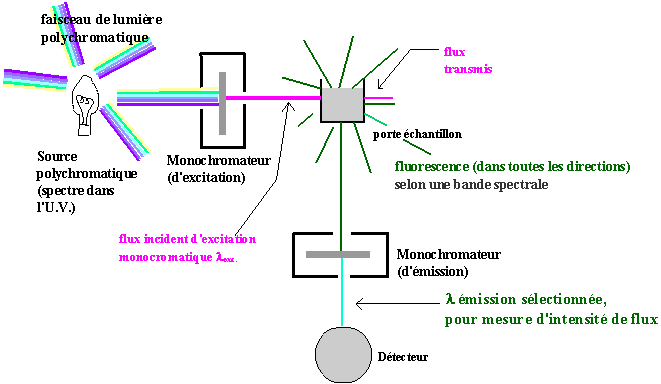 |
• On "réglera" 2 longueurs d'onde λ : excitation et émission. • Dans l'U.V. l'usage de portes échantillons en quartz est nécessaire, en tous cas de plastiques transparents aux λ utilisées. • Le détecteur mesure une intensité de flux de photons et répond par un signal proportionnel (donc une unité arbitraire proportionnelle). |
Un spectre d'absorption trace l'absorbance en fonction de λ. Il s'obtient normalement à l'aide d'un spectrophotomètre. Lorsqu'une molécule fluoresce, le spectre d'absorption obtenu avec un spectrophotomètre standard est "biaisé" puisqu'une partie de la fluorescence émise l'est selon la direction de la lumière transmise (cf ci-dessus). En effet, comme les photocapteurs sont classiquement sensibles sur tout le spectre, il y aura biais.
Pour obtenir un spectre d'émission, on va :
•1. fixer une λ d'excitation (choisie grâce à la littérature ou au sein d'une bande forte
d'absorption conduisant à une fluorescence ; on pourra choisir λexc. vers un maximum d'absorption par exemple) ;
•2. balayer les λ d'émission en mesurant l'intensité de fluorescence. On obtient un spectre d'émission. Attention : comme les
photocapteurs ne répondent pas avec le même coefficient à toutes les λ, l'allure des spectres obtenus est très legèrement variable
d'un appareil à un autre (sauf appareil très particulier permettant de "compter les photons").
Pour obtenir un spectre d'excitation, on va :
•1. fixer une λ d'émission (choisie grâce à la littérature ou vers un maximum
d'émission obtenu comme ci-avant) ;
•2. balayer les λ d'excitation en mesurant l'intensité de fluorescence. On obtient un spectre d'excitation. Attention : comme les
photocapteurs ne répondent pas avec le même coefficient à toutes les λ et comme les sources ne donnent pas la même
énergie à toutes les λ, l'allure des spectres obtenus est très legèrement variable
d'un appareil à un autre.
Voici deux exemples associant un spectre d'absorption et un spectre d'émission.
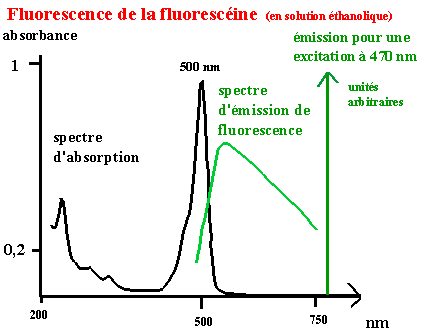 |
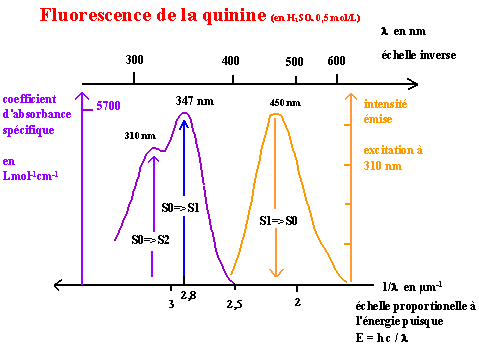 |
Voici un exemple associant un spectre d'excitation et un spectre d'émission pour le fluorochrome "TexasRed", un marqueur de fluorescence excitable dans le visible utilisé en cytométrie de flux.
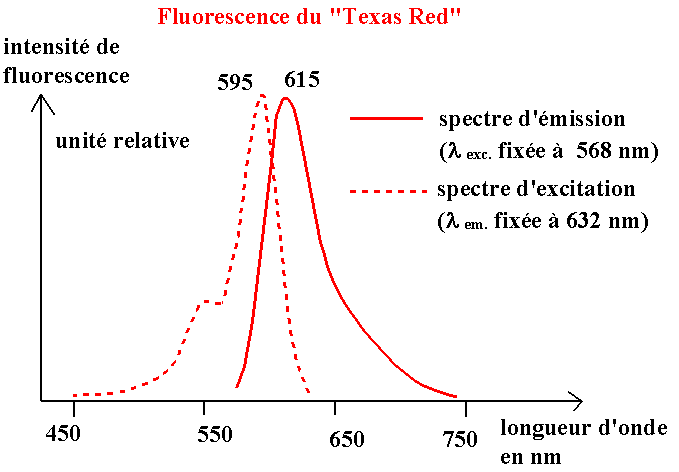
Le rendement quantique de fluorescence (YF) est défini comme le rapport (nombre de photons émis) / (nombre de photons absorbés). Si chaque désexcitation s'accompagne de
fluorescence Y=1.
L'efficacité de fluorescence prend elle en compte 2 phénomènes : l'efficacité à absorber la lumière vers l'état excité (donnée par la valeur du coefficient d'absorbance spécifique,
le ε de la loi de Beer-Lambert) et le rendement de fluorescence une fois l'état excité atteint (le rendement Y défini ci-avant).
Efficacité = YF * ε.
De façon simple et très empirique, on peut retenir que l'intensité de fluorescence pour une λexcitation et une λémission données est proportionnelle à la concentration du fluorochrome tant que la concentration n'est pas trop élevée (toutes choses étant égales par ailleurs !). Le toutes étant égales par ailleurs est fondamental puisque le rendement de fluorescence peut être très dépendant des conditions de milieu (force ionique, présence de quenchers ...). |
.jpg) |
Comme toujours en physique, on peut modéliser ... Vous pouvez ouvrir un nouveau cadre "pour en savoir plus" . (c'est plutôt du bac+3)
Au sens général l'effet "quenching" est un effet d'atténuation ou d'exctinction de fluorescence lié à la présence d'une molécule -le quencher- dans le milieu réactionnel. Classiquement on distingue 3 grands types de quenching : le quenching de collision (dit aussi dynamique), le quenching statique et le quenching par transfert d'énergie de l'état excité par résonance (RET ou FRET, Förster resonance energy transfert, Förster étant le découvreur du phénomène à la fin des années 1940).
• 3.5.1 Quenching par collision (qualifié aussi de quenching dynamique)
Soit F une molécule potentiellement fluorescente et F* son état excité.
Soit Q une autre molécule de l'échantillon à effet quencher par collision.
La fluorescence correspond à :
F + hν --> F* (excitation par absorption moléculaire) puis F* ---> F + hν (=fluorescence)
Le Quenching de collision par la molécule Q correspond à :
F* + collision avec Q --> F + Q + chaleur
La présence de Q a affaibli la fluorescence. Les ions iodures et le dioxygène sont des quenchers classiques.
• 3.5.2 Quenching statique
En biologie, on peut être amené à s'intéresser à des quenching dits statiques : le quencher à effet dit "statique" est en fait un ligand
d'une macromolécule portant un fluorochrome (par exemple une protéine à tryptophane conférant une fluorescence U.V.). Il y a quenching statique
lorsque la liaison du quencher à la macromolécule (le fluorochrome est au niveau du site de liaison) tue la fluorescence : le fluorochrome libre est fluorescent, le complexe quencher-fluorochrome n'est pas fluorescent. Les applications sont nombreuses ...
• 3.5.3 Quenching par transfert d'énergie de résonance
Lors d'un transfert d'énergie par résonance entre 1 groupement fluorescent A (donneur) et un groupement absorbant et/ou fluorescent B (receveur),
l'énergie associée à l'état excité de A est transférée par résonance sur B. C'est-à-dire que l'état A excité induit un champ électrique
oscillant qui entre en résonance avec les électrons de B si B possède la transition énergétique convenable : A se désexcite de façon non radiative alors que B passe à l'état excité.
Le retour de B excité vers l'état fondamental est alors soit non radiatif si B est un chromophore simple ou radiatif si B est un fluorescent (émission de lumière, luminescence de B).
La condition pour que le transfert d'énergie s'effectue est évidemment que le spectre d'émission du donneur A et le spectre d'excitation du receveur B se recouvrent.
Le transfert d'énergie par résonance est un transfert d'énergie à courte distance sous forme non radiative. Il exige une très grande proximité de A et B : 1 à 10 nm en règle générale. A titre de comparaison et d'échelle,
les longueurs de liaison covalente entre 2 atomes sont de 0,1 à 0,2 nm.
Les transferts d'énergie par résonance reçoivent de très très nombreuses applications en biologie - étude des intercations entre protéines, fabrication de biosenseurs, sondes pour biologie moléculaires ... - et un chapitre dédié est consacré à ces techniques. Voir le chapitre intitulé "Transferts d'énergie par résonance, FRET, BRET".