Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2014
[A propos de l'auteur]
[Droits de copie]
Ci-dessous la structure du NAD+ : Nicotinamide Adénine Dinucléotide.
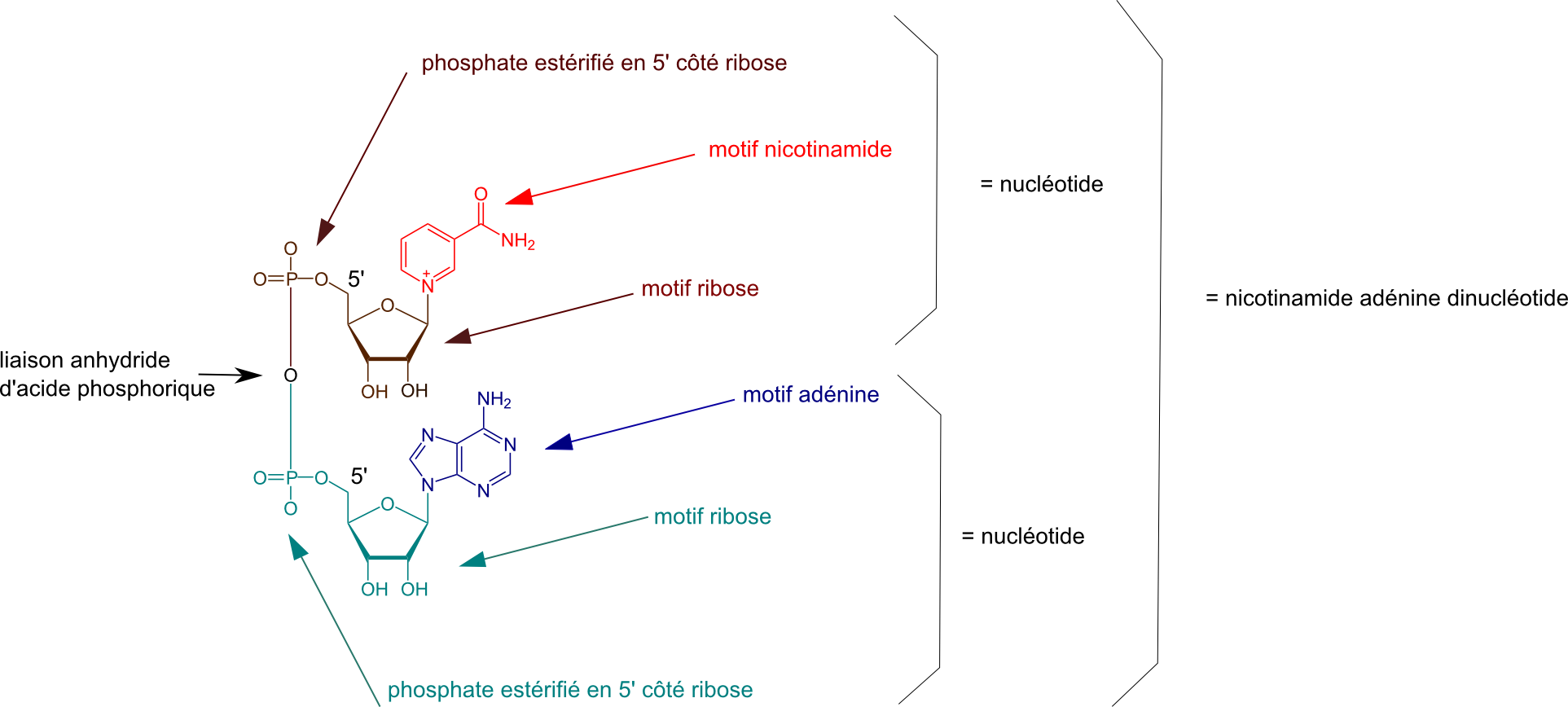
Les propriétés redox du couple NAD+/NADH sont liées au noyau nicotinamide.
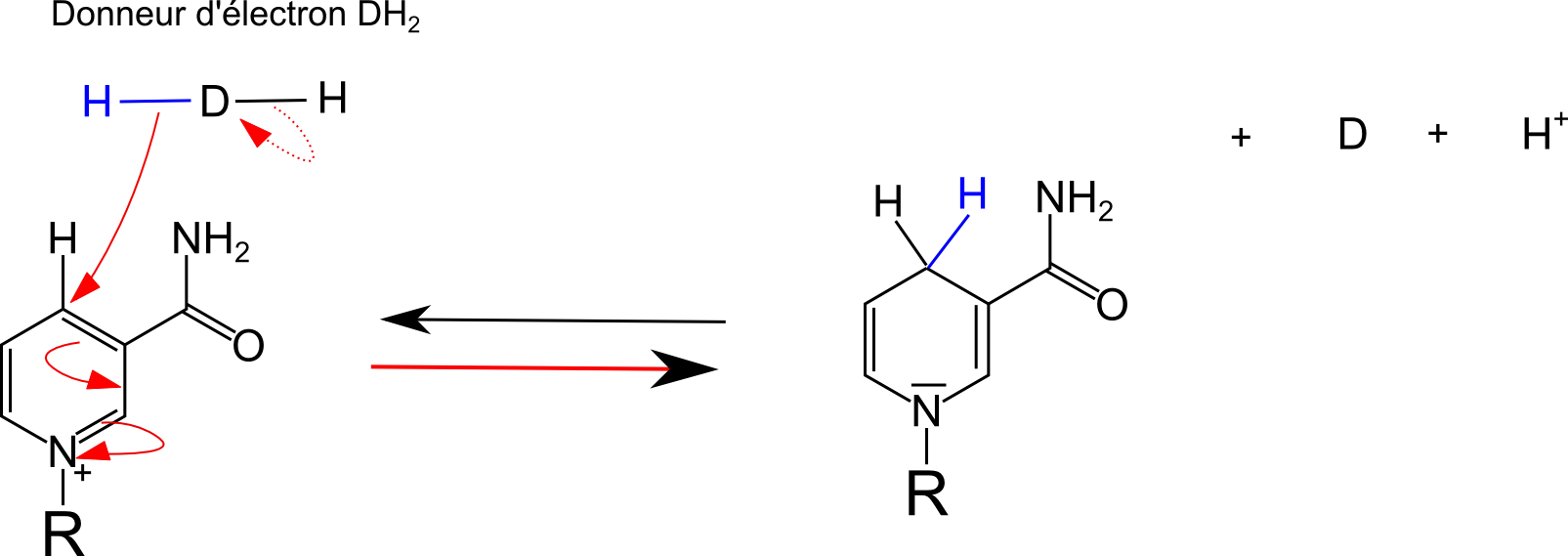
| Le potentiel redox standard du couple NAD+/NADH est de -0,32V, ce qui fait de NADH un réducteur très fort. Le coenzyme est réduit par "arrachage d'un hydrure" (un protons et 2 électrons) à un donneur d'électrons (cf. figure à gauche) avec stabilisation grâce à l'azote du noyau nicotinamide Le couple NAD+/NADH fonctionne de façon réversible, dans les 2 sens. On retiendra l'expression usuelle NADH "a pris en charge" 2 électrons lorsqu'il est à l'état réduit NADH. |
Le couple NAD+/NADH est le plus souvent coenzyme cosubstrat. 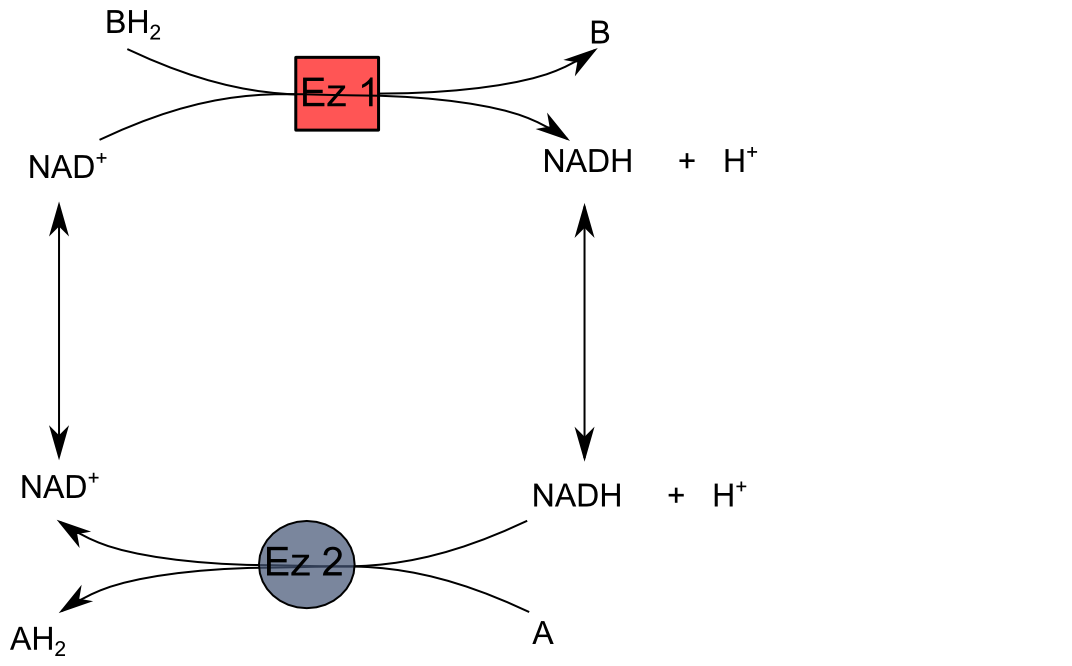 |
Mais le couple NAD+/NADH est aussi rencontré comme coenzyme groupement prosthétique, par exemple chez la glyceraldéhyde-3-phosphate déshydrogénase. Un cas intéressant puisqu'on y trouve le couple NAD+/NADH comme groupement prosthétique et aussi comme cosubstrat ! (Comment coupler l'oxydation de la fonction aldéhyde du 3-phosphoglyceraldéhyde à la réalisation d'un anhydride d'acide à haut potentiel d'hydrolyse et ...). 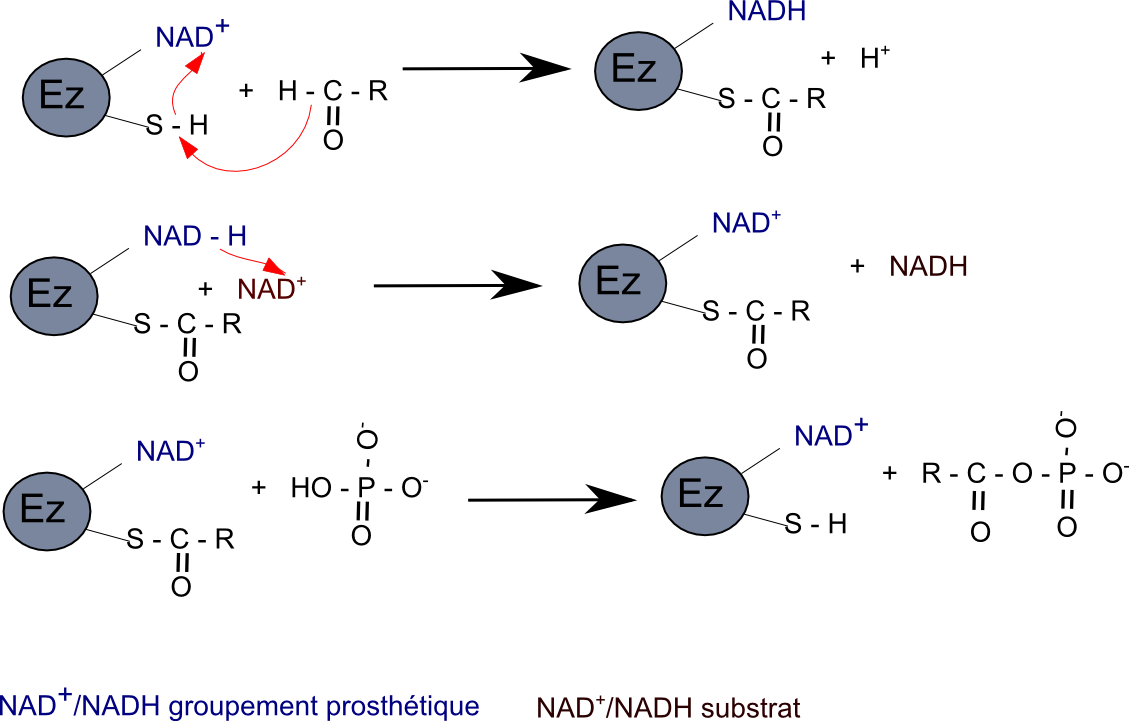 |
NADP diffère de NAD par un groupement phosphate estérifié en 2' du ribose de l'adénosine. Les propriétés redox sont identiques mais le couple NADP+/NADPH nest pas reconnu par les mêmes enzymes que le couple NAD+/NADH. Grosso-modo NAD+/NADH est coenzyme redox dans les réactions du métabolisme énergétique et NADP+/NADPH est utilisé comme source de pouvoir réducteur pour les biosynthèses nécessitant des réductions.
Les mammifères ne savent pas biosynthétiser le noyau nicotinamide qui a ainsi le statut de vitamine. En fait le noyau nicotinamide peut être remplacé dans l'alimentation par de l'acide nicotinique (sera efficacement amidé). Finalement les apports alimentaires en acide nicotinique (= niacine = vitamine B3), nicotinamide et NAD, NADP sont équivalents.
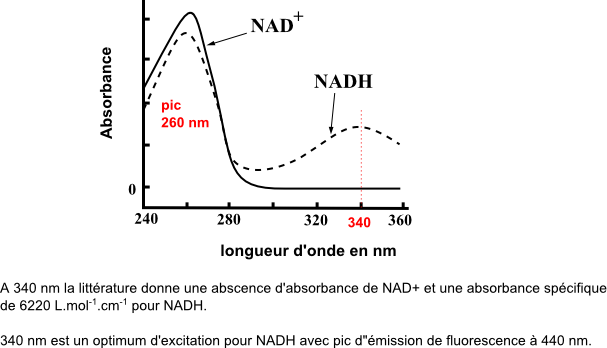
Les propriétés d'absorption U.V-visible et de fluorescence des couples NAD+/NADH et NADP+/NADPH sont remarquables. NAD+/NADH est ainsi très utilisés comme signal d'absorbance ou de fluorescence dans des systèmes de dosages : dosages de substrats au point final ou en cinétique avec réactions couplées à oxido-réductases à NAD, dosages d'activités enzymatiques à réactions couplées à oxido-réductases à NAD ... (voir aussi http://www.perrin33.com/enzym/tech/mesuredenzymesactivite-3.php). Ci-dessous spectres d'absorption et données caractéristiques.
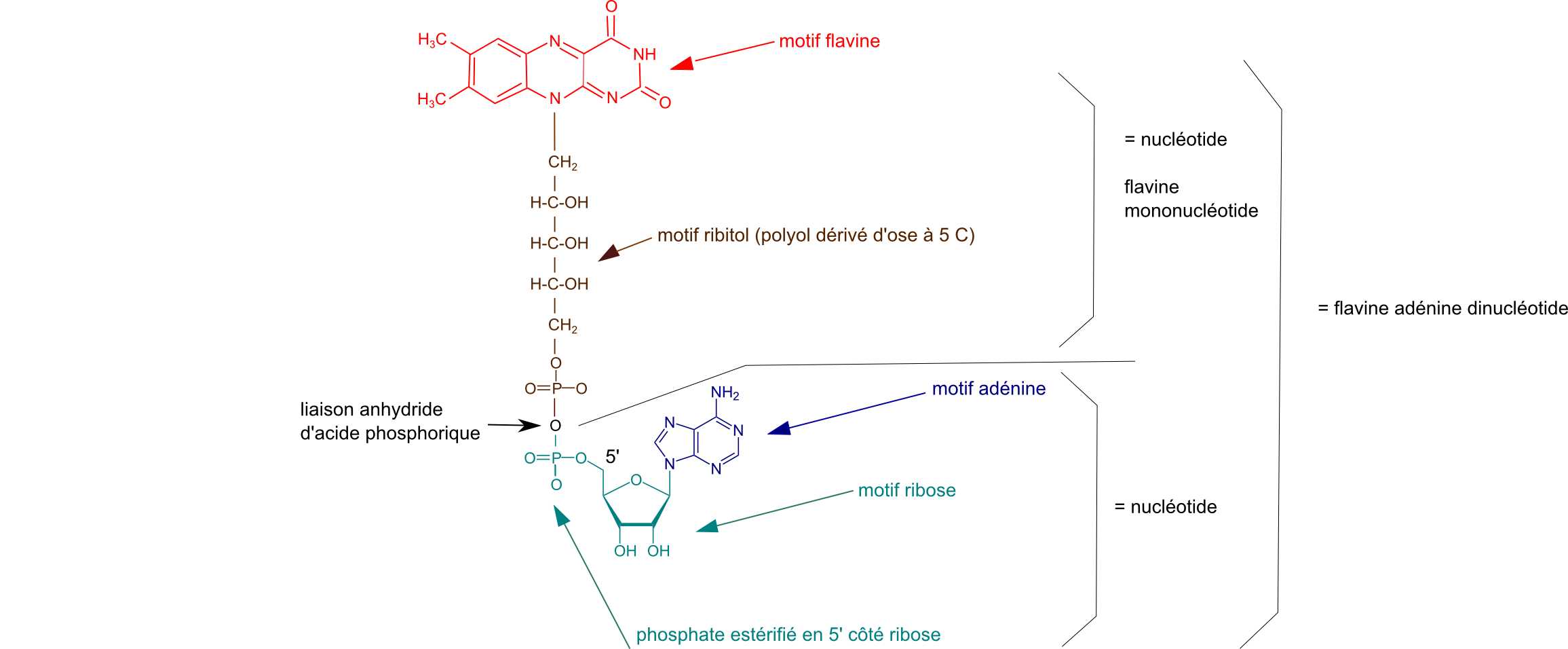
Ci-dessous la structure du FAD et de la FMN :
Les propriétés redox du couple FAD/FADH2 et du couple FMN/FMNH2 sont liées au noyau flavine. On écrit classiquement que FAD/FADH2 et FMN/FMNH2 transportent 2 électrons ce qui
revient à écrire :
FAD + 2H+ + 2e <-----> FADH2 et FMN + 2H+ + 2e <-----> FMNH2
Voici deux schémas redox simples : 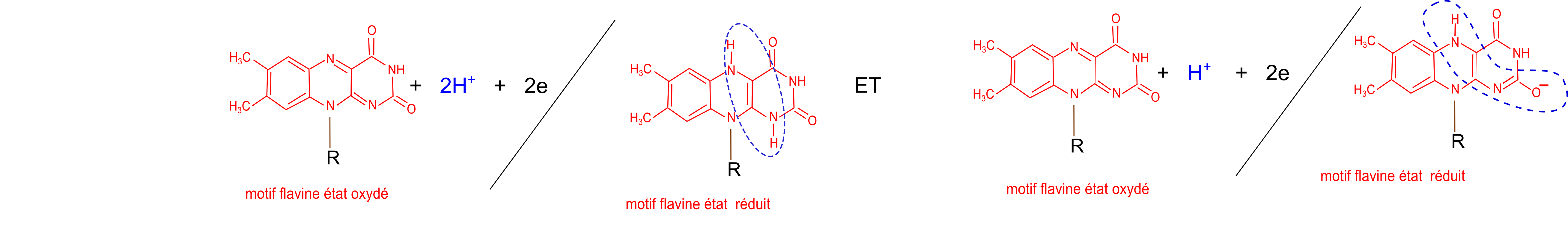
La chimie redox des couples FAD/FADH2 et FMN/FMNH2 est en réalité assez complexe. Les très curieux peuvent consulter les détails à http://www.ebi.ac.uk/thornton-srv/databases/CoFactor/mechanism.php?cid=2&pidArray=Array&oneDigitRefs=Array
La Flavine adénine dinucléotide (FAD) est un cofacteur d'enzyme d'oxydo-réduction associée aux enzymes de la classe des oxydo-réductases auxquelles elle est liée par une liaison covalente : c'est un groupement prosthétique. Ce cofacteur prosthétique est notamment utilisé par les flavoprotéines du complexe II de la chaîne respiratoire mitochondriale : Glycérol 3-P déshydrogénase, AcylCoA déshydrogénase, la très célèbre Succinate déshydrogénase.
Les mammifères ne savent pas biosynthétiser le noyau flavine qui a ainsi le statut de vitamine = vitamine B2 (forme classique riboflavine).
Voici la structure ferroporphyrine = hème d'après un lien vers "EMBL-EBI-cofactor-the organic enzyme cofactor database"

Ce type de cofacteur est chimiquement de type complexe organométallique (noyau organique porphyrine dit aussi tétrapyrrolique avec fe3+/fe2+ chélaté). Les hèmes sont des groupements prosthétiques liés de façon covalente à leur apoenzyme.
Les motifs hèmes sont retrouvés dans de très nombreuses protéines des complexes respiratoires ou intervenant dans les processus respiratoires. Ces protéines sont qualifiées de cytochromiques. A la place du fer,
on trouve parfois du cuivre Cu2+/Cu+. Les hèmes des cytochromes sont des transporteurs d'électrons :
hème-fe3+ + e <-----> hème-fe2+
On trouve aussi des protéines à hème dans diverses réactions redox des organismes : oxydations de détoxification par le cytochrome P450 chez les animaux, oxygénations par diverses oxygénases...
Note. Attention, une protéine comme l'hémoglobine contient 4 hèmes liés. Mais le transport du dioxygène, qui dépend des hèmes, ne fait pas intervenir de réaction redox sur le fer qui doit demeurer absolument à l'état fe2+. Il y a en revanche modifications des liaisons de coordinence du fe2+ : 5 coordinences si désoxygéné, 6 quand le dioxygène est chélaté. Voir http://www.perrin33.com/enzym/allosterie_2.php
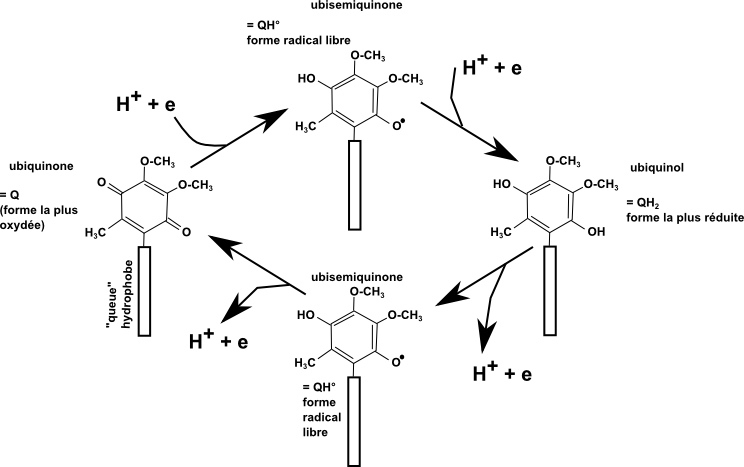
L'ubiquinone ou coenzyme Q est une coenzyme membrane soluble. C'est notamment l'intermédiaire redox entre le complexe 1 et le complexe 3 de la chaîne respiratoire mitochondriale. On le retrouve aussi dans de très très nombreuses chaînes respiratoires bactériennes. Les plastoquinones, intermédiaires redox dans la photosynthèse ont une structure très proche et un fonctionnement identique.
Voici la structure de l'ubiquinone d'après un lien vers "EMBL-EBI-cofactor-the organic enzyme cofactor database" :

Voici un schéma de réactivité dans le contexte de la chaîne respiratoire mitochondriale :