Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2014
[A propos de l'auteur]
[Droits de copie]
Le (on devrait dire la) coenzyme A est une coenzyme transporteur de groupements acyls ainsi "activés" vers de nombreuses enzymes. Il est formé d'un motif acide pantothénique (qui a le statut de vitamine chez l'humain, vitamine B5) amidé avec une cystéine et estérifié avec une adénosine 3'-phosphate 5'-diphosphate. On le symbolise souvent par l'écriture HS-CoA.
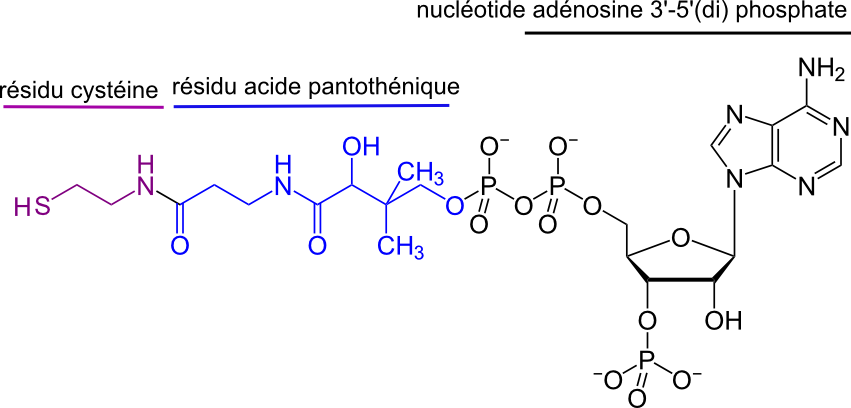
Rappelons quelques réactions importantes où intervient le coenzyme A.
1• Avant l'entrée du cycle de Krebs, le complexe pyruvate déshydrogénase catalyse H3C-CO-COO- (pyruvate) + HS-CoA + NAD+ ----> H3-CO-S-CoA (acétylCoA)+ CO2 + NADH
2• La première réaction du cycle de Krebs : H3-CO-S-CoA (acétylCoA)+ -OOC-CH2-CO-COO- (oxaloacétate) + H2O ------> -OOC-CH2-C(OH)(CH2-COO-)-COO- (citrate) + HS-CoA
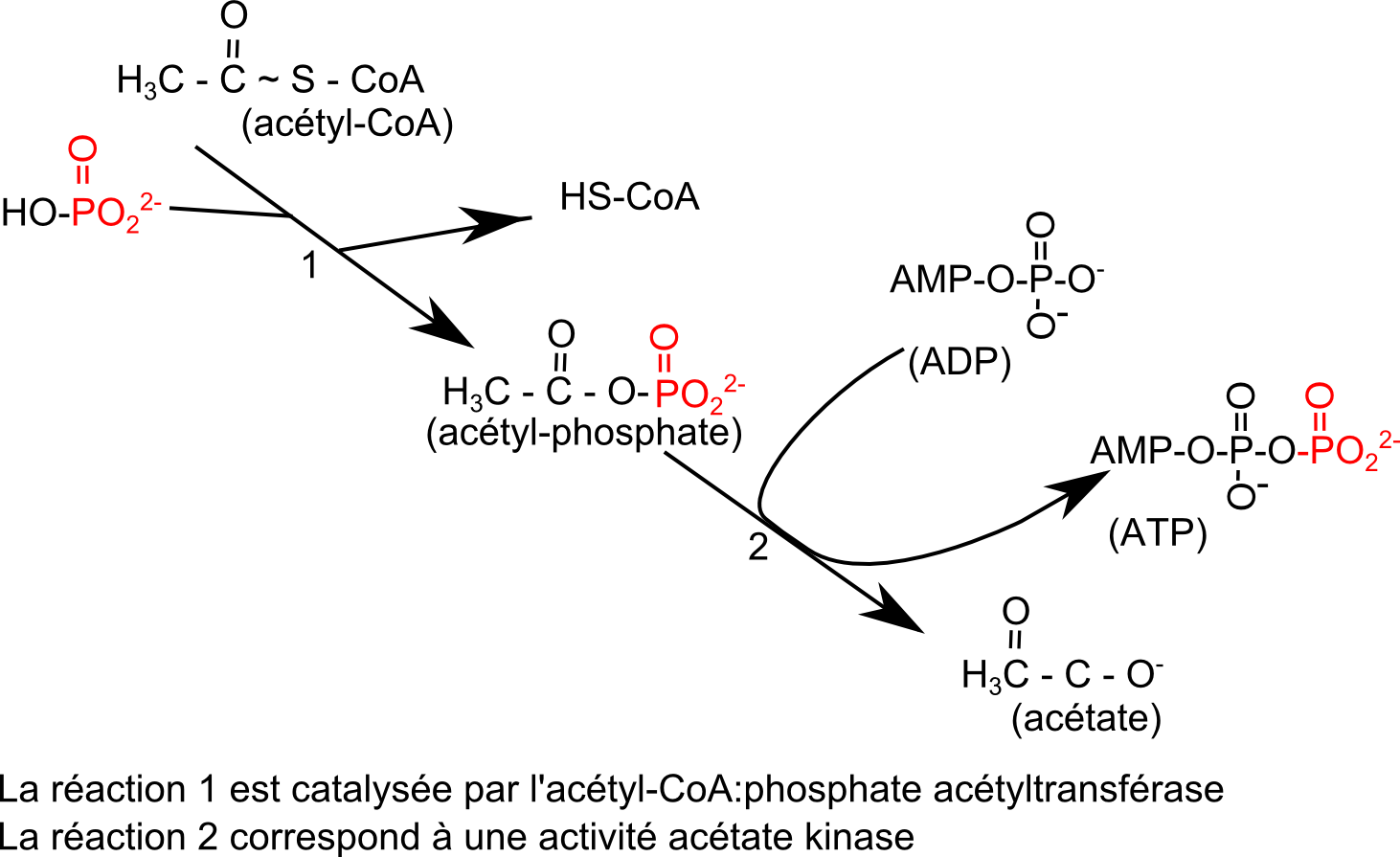
3• Rappelons que la liaison thioester d'un acylcoA est une liaison à haut potentiel d'hydrolyse. Ainsi les acylCoA qui apparaissent dans de nombreuses fermentations peuvent conduire à la régénération d'ATP par phosphorylation au niveau du substrat. Ci-dessous un schéma simple dans le cas de l'acétylcoA :
4• Et on ne pouvait pas oublier tous les intermédiaires acylCoA de l'hélice de Lynen, voie catabolique d'oxydation des acides gras, 2C par 2C, en acétylCoA. Voir par exemple : http://www.snv.jussieu.fr/bmedia/Metabo/hlynen.htm.
Le pyridoxal 5'-phosphate (PLP) est un cofacteur organique rencontré comme groupement prosthétique ou coenzyme qui intervient dans de nombreuses réactions du métabolisme des acides aminés : transamination, décarboxylation, racémisation, oxydation de fonction amine ... Chez l'humain, il a statut de vitamine, la vitamine B6.
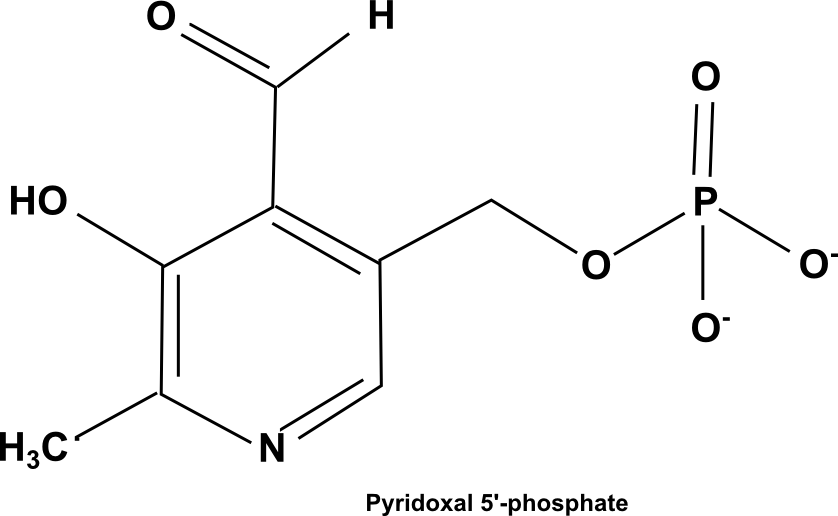
Dans ce paragraphe seule son action dans les réactions de transamination sera présentée.
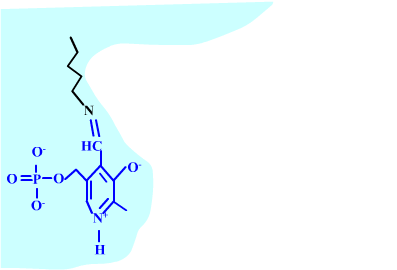
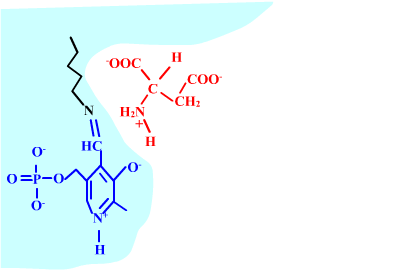
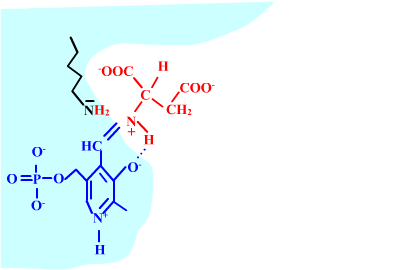
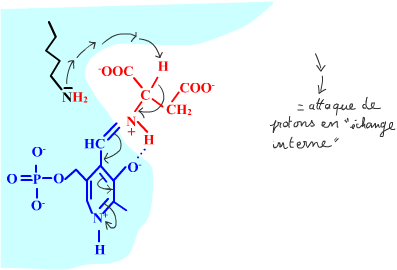
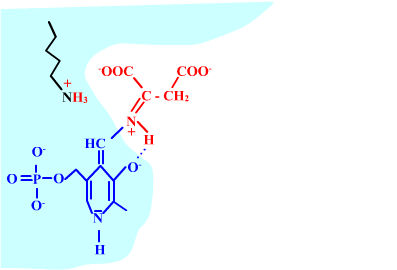
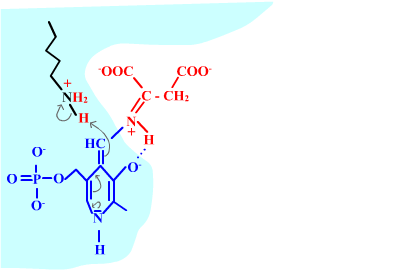
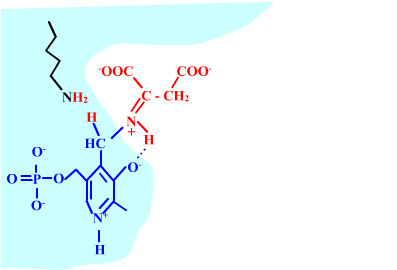
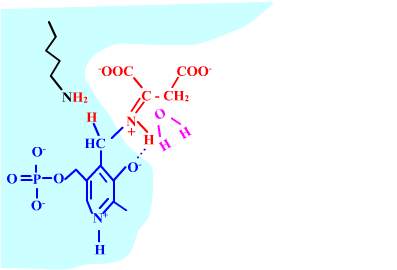
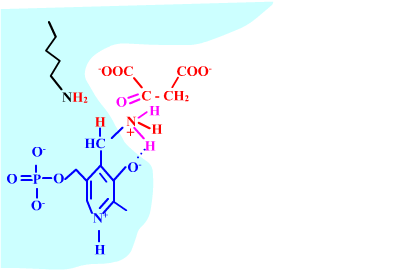
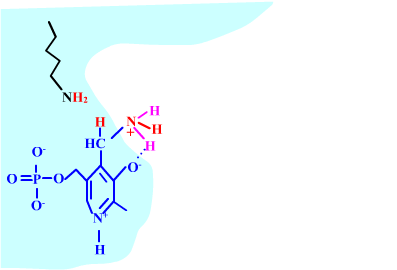
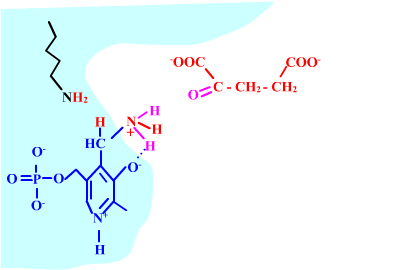
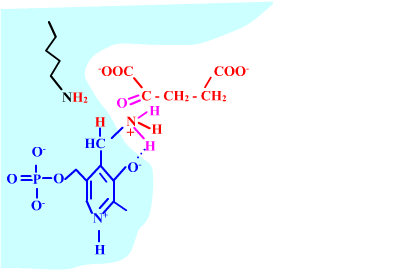
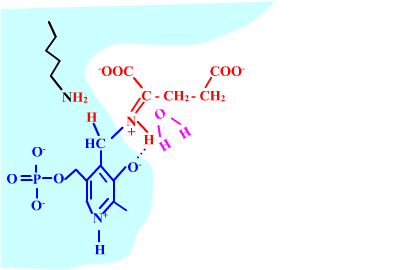
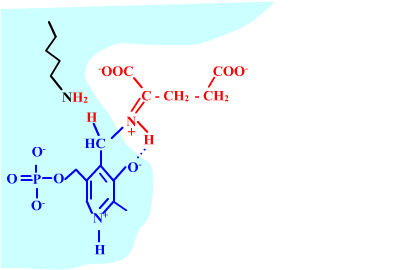
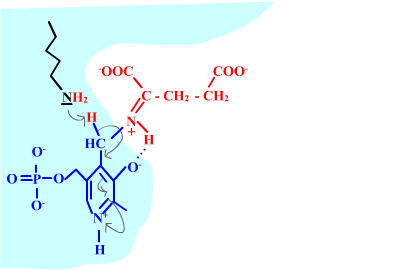
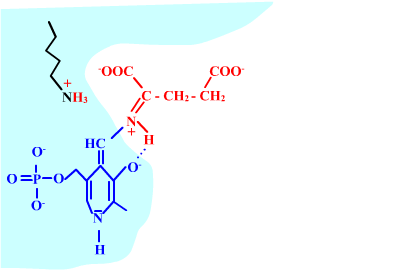
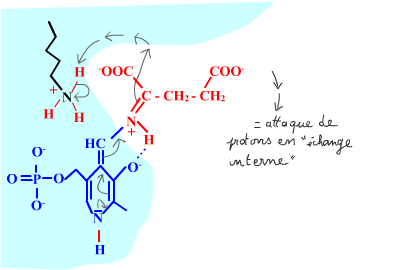
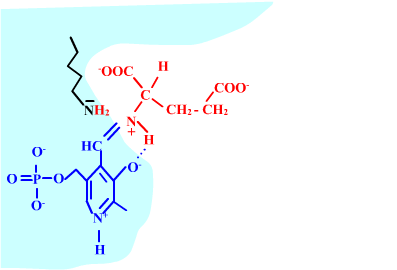
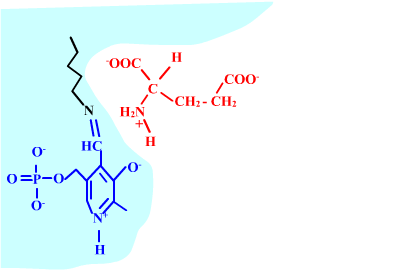
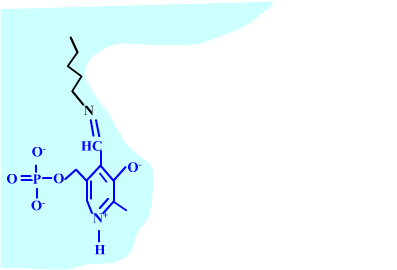
Les enzymes transaminases travaillent grâce pyridoxal-5'-phosphate, intervenant majeur de la réaction, selon un mécanisme réactionnel ping-pong. Le PLP est lié à une lysine par liaison covalente (sous forme d'une base de Schiff, aldimine) = forme enzyme-PLP. C'est le PLP qui "recoit et transfert" la fonction alpha-amine d'un acide aminé. Il se retrouve alors sous forme amine (PMP, pyridoxamine) puis de nouveau sous forme PLP. La forme PMP demeure liée dans le site actif, mais par liaisons ioniques, d'où l'écriture "enzyme,PMP" dans le schéma ci-dessous qui utilise l'exemple de l'aspartate aminotransférase.
Aspartate + enzyme-PLP <-----> oxaloacétate + enzyme,PMP
2-oxoglutarate + enzyme,PMP <-----> glutamate + enzyme-PLP
----------------------------------------------------------------------------------------------------
Aspartate + 2-oxoglutarate <----> Oxaloacétate + glutamate
Voici la chimie du processus :
Il joue un rôle fondamental dans le métabolisme des groupements à 1 carbone: transporteur et donneur de groupements -CH3, =CH2, =CH-, -HC=. Dans son cycle de fonctionnement l'ensemble des folates existe sous de très nombreuses formes en interconversions cycliques. La collection des folates (le "pool" folates) intervient notamment dans les réactions de biosynthèse des bases puriques et lors de la synthèse des bases pyrimidiques dans la réaction de conversion du dTMP à partir du dUMP (réaction catalysée par la thymidylate synthase). Le noyau folate a le statut de vitamine (vitamine B9) chez les humains.
Note 1. La thimidylate synthase utilise du tétrahydrofolate-N5,N10-méthylène (Me-THF) et produit du dihydrofolate (DHF). Le DHF est régénéré en tétrahydrofaolate (THF) par la dihydrofolate réductase NADPH dépendante puis en
Me-THHF par la sérine-hydroxyméthyl-tranférase. Les cellules incapables de régénérer le THF ont une synthèse de l'ADN déficiente et meurent. Pour cette raison,
mais aussi du fait que le dTTP n'est utilisé que dans la biosynthèse de l'ADN, il est possible de cibler les cellules en prolifération rapide des cellules ne proliférant pas en inhibant la dihydrofolate
réductase NADPH dépendante. De tels inhibiteurs sont utilisés en cancérologie : methotrexate, aminopterin, and trimethoprim (ce sont des analogues de l'acide folique).
Une image accessible à
http://oregonstate.edu/instruct/bb350/ahernmaterials/a23/23p81.jpg détaille simplement les réactions évoquées ci-dessus On pourra en apprendre plus sur la synthèse des purines et pyrimidines en consultant par exemple http://www.columbia.edu/cu/biology/courses/w3034/Larry/readings/PurineChapter/PurineChapter.html.
Note 2. Les bactéries biosynthétisent le noyau folate. Chez les bactéries, les sulfonamides agissent comme compétiteur de substrat de l'enzyme dihydroptéroate synthétase, une enzyme engagée dans la biosynthèse des folates. Les sulfonamides se comportent ainsi en antibiotique à effet bactériostatique (inhibition de croissance mais pas d'effet mortel). Les humains acquièrent, eux, les folates (vitamine B9) par leur alimentation. L'article anglais de Wikipedia sur les sulfonamides est bien fait : http://en.wikipedia.org/wiki/Sulfonamide_%28medicine%29 (consultation 22/11/2014).
Voilà une triplette qui se comporte en coenzyme : Les 3 formes sont en interconversion cyclique en faisant la navette comme substrats et produits entre différentes enzymes ! Un transport de " phosphate énergétisé" par la très spéciale liaison anhydride d'acide phosphorique entre les phosphates 1 et 2 et 2 et 3 de l'ATP... Voir un cours de biochimie métabolique.
Voir le site "CoFactor - The organic enzyme cofactor database" de l'EMBL-EBI http://www.ebi.ac.uk/thornton-srv/databases/CoFactor/...