Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour octobre 2012
[A propos de l'auteur]
[Droits de copie]
Lentreprise X commercialise des préparations β-galactosidase de E. coli partiellement purifées (appelées gal-prepx).
L'unité de β-galactosidase (U) est définie par la catalyse de 1 µmol de substrat ONPG par minute à 37°C, à pH 7,3 dans le tampon standard (ONPG 4 mM et tampon Tris-Hcl 0,1 mol/L pH 7 + MgCl2 1 mmol/L + 2 mercaptoéthanol 1 mmol/L). L'ONPG (2-nitrophénol-β-galactopyranoside) est hydrolysé en ONP (2-nitrophénol) qui absorbe fortement à l'état déprotoné (pH suffisamment alcalin) à 420 nm. L'ONPG n'absorbe pas à 420 nm et le coefficient d'absorbance spécifique de l'ONP à 420 nm est ε=2200 L.mol-1.cm-1 dans les conditions du standard de mesure d'activités catalytiques.
Dans 2,97 mL de milieu standard à 37°C, on introduit 30 µL de gal-prepx diluée au 1/100. On mesure l'augmentation d'absorbance à 415 nm en période de vitesse initiale, l=1 cm de trajet optique. Le résultat obtenu est ΔA/Δt = 0,220 min-1.
On peut donc ainsi calculer la vitesse initiale de réaction : |
On obtient vi = 0,220/(2200*1) = 1.10-4 mol.L-1.min-1 |
Mais il est plus intéressant de calculer l'activité catalytique
des 30 µL de gal-prepx diluée au 1/100. |
Le résultat numérique obtenu est : |
Et on peut surtout calculer la concentration en activité
catalytique de la préparation gal-prepx. |
Le résultat numérique obtenu est : |
Voici les caractéristiques de 2 préparations β-galactosidases commercialisées par X et Y :
| Vendeur | Concentration catalytique en U/mL |
Concentration en protéines totales en mg/mL |
Conditionnement | Prix |
| X | b = 1000 U/mL | ρ = 1 mg/mL | v=1 mL | 150 |
| Y | b = 2000 U/mL | ρ = 4 mg/mL | v = 5 mL | 800 |
Ce tableau permet d'en construire un nouveau permettant une comparaison entre les préparations X et Y :
| Vendeur | Concentration catalytique en U/mL |
Concentration en protéines totales en mg/mL |
Conditionnement | Prix | activité spécifique |
prix à l'unité |
| X | b = 1000 U/mL | ρ = 1 mg/mL | v=1 mL | tarif = 150 | = 1000/1 = 1000 U/mg |
= 150/(1000*1) = 0,15 /U |
| Y | b = 2000 U/mL | ρ = 4 mg/mL | v = 5 mL | tarif = 800 | = 2000/4 = 500 U/mg |
= 800/(2000*5) = 0,08 /U |
D'où il ressort que la préparation X est plus purifiée que la préparation Y (2 fois plus) mais que le coût à l'unité de la préparation X est presque 2 fois plus élevé que chez Y.
On dispose d'une préparation de l'endonucléase de restriction Hind III. Il s'agit de mesurer sa concentration en activité catalytique.
L'unité d'activité catalytique endonucléase de restriction est ainsi définie : 1 unité (U) d'enzyme hydrolyse spécifiquement et totalement tous les sites de restriction présents dans 1000 ng d'ADN non méthylé du phage λ en 1 heure à 37°C, dans les conditions standardisées de réaction (sous un volume total de 50 µL, en respectant une composition stricte de milieu tamponné réactionnel).
L'hydrolyse de tous les sites Hind III du phage λ conduit à 8 fragments double brins de 23130, 9416, 6557, 4361, 2322, 2027, 564 et 125 paires de bases.
Voici le résumé d'une expérience de détermination de concentration en activité :
Référence du tube |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
ADN de λ |
2 µL de stock à 500 ng/µL (soit 1000 ng) |
||||||||
Tampon standard H 10x |
5 µL |
||||||||
Eau stérile |
42 µL |
41 µL |
40 µL |
42 µL |
41 µL |
40 µL |
42 µL |
41 µL |
40 µL |
Préparation Hind III |
1 µL |
2 µL |
3 µL |
1 µL |
2 µL |
3 µL |
1 µL |
2 µL |
3 µL |
Préparation Hind III diluée au 1/30 |
Préparation Hind III diluée au 1/20 |
Préparation Hind III diluée au 1/10 |
|||||||
|
Homogénéisation et incubation 60 minutes à 37°C |
||||||||
|
Puis ajout de 25 µL de solution d'arrêt et de charge pour analyse électrophorétique. Homogénéisation immédiate et incubation 5 minutes à 60°C. |
||||||||
|
L'analyse des produits d'hydrolyse de l'ADN du phage est alors réalisée par séparation électrophorétique, en gel d'agarose, des fragments d'ADN linéaires obtenus puis révélation grâce à une coloration en fluorescence. Ainsi, 15 µL du contenu de chaque tube 1 à 9 sont déposés dans le puits d'un gel d'agarose à 1 %. La migration est conduite sous un champ électrique de 5 V/cm. Les résultats sont observés en fluorescence après révélation. Les résultats de l'électrophorèse sont présentés ci-dessous. |
||||||||
|
Piste 0 : témoin ADN linéaire de phage λ non digéré. Pistes 1 à 9 : le contenu des tubes réactionnels 1 à 9 respectivement, comme indiqué ci-dessus. L'échelle de droite indique la taille en paires de bases des fragments d'ADN révélés déduits de la carte de restriction de l'ADN du phage. La technique utilisée ici ne permet de visualiser ni le fragment à 125 paires de bases ni celui à 564 paires de base. |
Les pistes 1 et 4 montrent une hydrolyse partielle (bandes surnuméraires) et
les autres pistes une hydrolyse complète spécifique. On peut donc dire que :
• Il y a moins d'une unité d'activité dans 1 µL de préparation Hind III
au 1/30 et plus d'une unité dans 2 µL de préparation Hind III au 1/30. C'est à
dire 15 U/µL < bHind III < 30 U/µL
• Il y a moins d'une unité d'activité dans 1 µL de préparation Hind III
au 1/20 et plus d'une unité dans 2 µL de préparation Hind III au 1/20. C'est à
dire 10 U/µL < bHind III < 20 U/µL
En combinant ces 2 inégalités, on peut affirmer que 15 U/µL < bHind III < 20 U/µL
l'enzyme (5-L-glutamyl)-peptide:amino-acid 5-glutamyltransferase appelée plus couramment γ-glutamyltranférase (EC 2.3.2.2, γGT) est une enzyme impliquée dans les systèmes antioxydants des mammifères. Sa présence à concentration élevée dans le plasma est un bon indice d'anomalie hépatique en liaison à des problèmes d'alcoolisme, d'hépatites virales cancéreuses ou médicamenteuses ... la concentration en activité catalytique γGT du plasma est une mesure classique des laboratoires d'analyses médicales.
La réaction catalysée est : (5-L-glutamyl)-peptide + aminoacide = peptide + (5-L-glutamyl)-aminoacide
Le standard IFCC de mesure de l'enzyme utilise la réaction :
5-L-glutamyl-3-carboxy-4-nitroanilide + glycylglycine = 5-amino-2-nitrobenzoate
+ 5-L-glutamylglycylglycine
Le 5-amino-2-nitrobenzoate absorbe à 410 nm et le suivi d'absorbance permet le
suivi cinétique de la réaction catalysée.
Le standard de mesure des activités résumé (IFCC, 2002, voir bibliographie)
est le suivant :
- 2,00 mL de solution Glycylglycine 37°C + 0,250 mL d'échantillon vers 37°C
puis 3 minutes d'équilibration + 0,5 mL de solution substrat
5-L-glutamyl-3-carboxy-4-nitroanilide 37°C. la vitesse initiale de réaction est
alors mesurée sur 3 minutes après 60 secondes de latence. Les conditions dans
le milieu réactionnel final sont Glycylglycine 150 mmol/L,
5-L-glutamyl-3-carboxy-4-nitroanilide 6 mmol/L, pH 7,7, 37°C ± 0,1°C. Et on a
finalement 1 volume d'échantillon introduit plus 10 volumes des 2 réactifs.
Linéarité juqu'à 0,2 d'absorbance par minute.
- Un témoin de vitesse de réaction spontanée (blanc réactif) est réalisé en
remplaçant l'échantillon par de l'eau à 9g/L en NaCl et la valeur (normalement
<0,001 /min). La valeur obtenue est soustraite des mesures avec échantillon.
La formule de ce dosage est très simple :
(ΔA/Δt : variation d'absorbance par unité de temps après
correction du blanc réactif, ε : coef. d'absorbance spécifique du
5-amino-2-nitrobenzoate, l : trajet optique, Vmr : volume de milieu
réactionnel, E : volume d'échantillon)
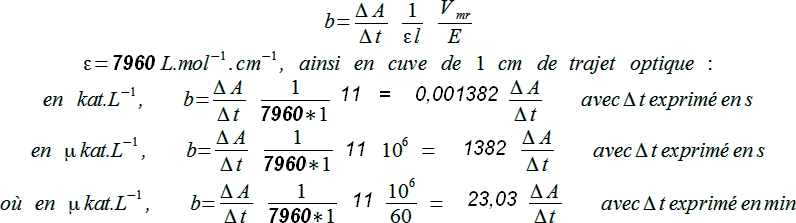
Ainsi une variation d'absorbance de 0,100 min-1 donne bγGT = 0,100*23,03 = 2,3 µkat/L. Cette valeur est pathologique puisque les valeurs limites de référence sont annoncées inférieures à 0,92 µkat/L chez l'homme et 0,63 µkat/L chez la femme.