Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour octobre 2012
[A propos de l'auteur]
[Droits de copie]
A est un coefficient (dimension d'un temps-1) qui peut être considéré comme constant dans le domaine des températures biologiques, R est la constante des gaz parfaits, T la température absolue et Ea l'énergie d'activation au sens d'Arrhénius de la réaction catalysée.
Ainsi, c'est la valeur de l'énergie d'activation qui détermine la sensibilité de l'augmentation de vitesse d'une réaction catalysée par une enzyme à l'augmentation de température. Et on peut se livrer à des calculs très simples et très informatifs si on connaît les valeurs d'énergie d'activation.
Soit un système réactionnel enzymatique donné. Soit la valeur de vitesse initiale vi-T1 à la température T1 et soit la valeur de vitesse initiale vi-T2 à la température T2, toutes choses égales par ailleurs. On a :
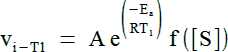 et
et
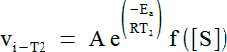
Où f([S]) désigne le fait que la vitesse dépend de la concentration des substrats, du pH ... tous ces paramètres étant fixés.
On peut donc calculer le rapport des 2 vitesses :
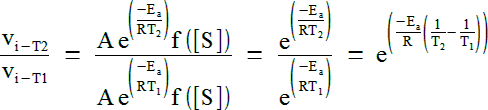
Il suffit alors de lancer quelques applications numériques de la formule ci-dessus pour des valeurs classiques de température et d'énergie d'activation et on obtient :
(Note bien calculer aux USI avec les températures en °K !)
| Energie d'activation en J/mol | vi-38°C/vi-36°C | Conclusion : | vi-37,2°C/vi-36,8°C | Conclusion : |
| 30 000 | 1,08 | Jusqu'à 8% d'écart entre 2 résultats par le fait des seuls écarts de temmpérature à ±1°C | 1,015 | Moins de 2% de fluctuation des résultats à ±0,2°C |
| 50 000 | 1,13 | Jusqu'à 13% d'écart entre 2 résultats par le fait des seuls écarts de temmpérature à ±1°C | 1,025 | Moins de 3% de fluctuation des résultats à ±0,2°C |
| 75 000 | 1,21 | Jusqu'à 21% d'écart entre 2 résultats par le fait des seuls écarts de temmpérature à ±1°C ! | 1,038 | Moins de 4% de fluctuation des résultats à ±0,2°C |
A méditer selon les contraintes de qualité qu'on s'est donné sur les déterminations d'activité ...
Pour information, l'IFCC indique 37±0,1°C dans les description des standards de référence pour les mesures d'activité catalytique en biologie clinique.