Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2009/2015
[A propos de l'auteur]
[Droits de copie]
On a vu dans le paragraphe 4, le mode de résistance associée à la production de β-lactamases. Il a conduit à la mise au point de nouvelles molécules β-lactames résistantes à l'hydrolyse par ces enzymes. Mais les bactéries montrent une grande "plasticité" de telle sorte qu'elles finissent toujours par parvenir à "inventer" des β-lactamases hydrolysant les nouveaux β-lactames.
Une stratégie consiste à mettre au point des inhibiteurs de β-lactamases (analogie militaire : transpeptidase = cible stratégique ; antibiotique β-lactame = missile ; β-lactamases = antimissile ; inhibiteur de β-lactamase = anti-anti-missile).
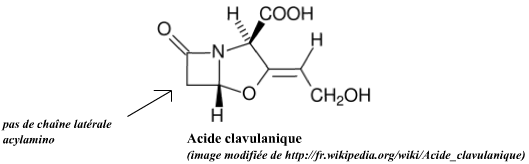
L'acide clavulanique est un inhibiteur célèbre de certaines β-lactamases (en fait certaines β-lactamases à sérine active). Il présente un motif appelé clavame qui est de structure voisine du motif β-lactame. Il lie de façon covalente quasi irréversible une partie de sa structure chimique aux β-lactamase cibles (notamment au niveau de la sérine active), empêchant leur action ultérieure sur l'antibiotique coadministré (le médicament connu sous l'appellation augmentin = amoxicilline + acide clavulanique). Encore une histoire d'acyl-enzyme devenu stable et donc de substrat suicide ...