Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2020
[A propos de l'auteur]
[Droits de copie]
![]()
Sous l'effet combiné d'une température élevée (100°C classiquement) et du SDS (un détergent anionique chaotropique), en présence d'un agent réducteur (2-mercaptoéthanol ou dithiothréitol), toutes les sous unités polypeptidiques des protéines perdent leurs ponts disulfures éventuels, sont séparées, sont dénaturées et il y a formation d'associations SDS - sous unité polypeptidiques. Dans le cas de protéines globulaires hydrosolubles, quel que soit le polypeptide, toutes les associations SDS - unité polypeptidique présentent un ratio SDS/polypeptide presque identique vers 1,4 g/g et finalement la même densité de charge (le rapport la charge q au rayon hydrodynamique r) et donc la même mobilité en veine liquide.
Le 2-mercaptoéthanol (HO-CH2CH2-SH = RSH ) ou le dithiothréitol (HS-CH2-CHOH-CHOH-CH2-SH, moins toxique) se comportent
en réducteur des ponts disulfures éventuels :
( 2 R-SH en excès + X-S-S-X --> R-S-S-R + X-SH HS-X). Ceci permet de séparer d'éventuelles sous-unités liées par ponts disulfures et d'assurer
le "dépliement" complet des polypeptides comportant des ponts disulfures (intrachaine).
Soit, par exemple, une protéine formée par l'assemblage de 4
sous unités polypeptiques, 2 unités symbolisées par  et 2 unités symbolisées par
et 2 unités symbolisées par  . La "chaîne
rouge" possède des ponts disulfures (-S-S-) symbolisés par des traits noirs.
Soit
. La "chaîne
rouge" possède des ponts disulfures (-S-S-) symbolisés par des traits noirs.
Soit 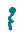 symbolisant le SDS.
symbolisant le SDS.
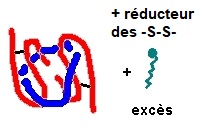 |
 |
 |
+ température vers 100°C + 2-mercaptoéthanol en excès |
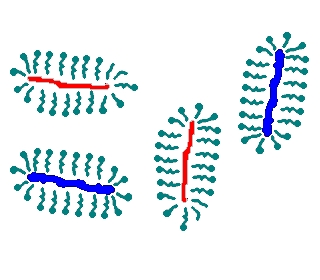
Chaque unité polypeptidique est isolée, dénaturée, réduite, sous forme d'association SDS-unité. Toutes ces associations (on pourrait presque parler de micelles SDS-unités mais ce n'en sont pas vraiment) ont la même densité de charge. |
Ce sont les associations SDS-unités ainsi obtenues qui vont être séparées par électrophorèse en gel de polyacrylamide. Comme toutes ces associations ont la même densité de charge et donc la même mobilité potentielle en veine liquide, c'est l'effet de tamisage moléculaire par le support gel qui sera mis en oeuvre pour exercer l'effet séparatif différentiel. Ce qui suppose donc de travailler avec un gel de porosité adaptée et parfaitement contrôlée ou avec un gel présentant un gradient de porosité.
=> La formation d'associations SDS-unités polypeptidiques n'est pas étonnante. Ce qui est remarquable c'est le phénomène densité de charge au quasi identique quelle que soit la séquence primaire pour les protéines globulaires.
Dans la partie séparative du gel d'électrophorèse (separating gel), les grosses associations sont plus freinées et/ou arrêtées par le maillage du gel que les petites. D'où un profil de migration du type :
Pour une porosité de gel donnée |
|
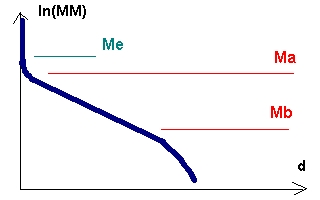 |
- Ln(MM) : ln de la masse moléculaire d'une unité polypeptidique (non
glycosylée). - d : distance parcourue dans le gel d'électrophorèse (parfois on travaille relativement à un colorant de densité de charge très élevée utilisé comme marqueur). - Me : au dessus de cette masse moléculaire d'unité polypeptidique, les micelles sont arrêtées par le maillage du gel - Ma et Mb : dans cet intervalle de masses moléculaires, la migration est une fonction linéaire du logarithme de la masse moléculaire : d = a * Ln(MM) + b. |
On peut vouloir révéler toutes les protéines du gel sans distinction. Dans ce cas de figure, on fixe (préciptation in situ, en général par une acidification) et on colore avec un colorant des protéines : bleu de Coomassie, méthodes aux sels de cuivre, au nitrate d'argent ... On révèle ainsi toutes les bandes protéiques séparées (avec une détectabilité plus ou moins élevée selon les techniques).
On peut ne vouloir révéler que certaines protéines grâce à des anticorps marqués contre des motifs d'intérêt. Dans ce cas, on met en oeuvre la technique dite de Western-blot qui permet, après transfert sur une membrane, d'utiliser une révélation par anticorps marqués. Voir chapitre dédié.