Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2020
[A propos de l'auteur]
[Droits de copie]
![]()
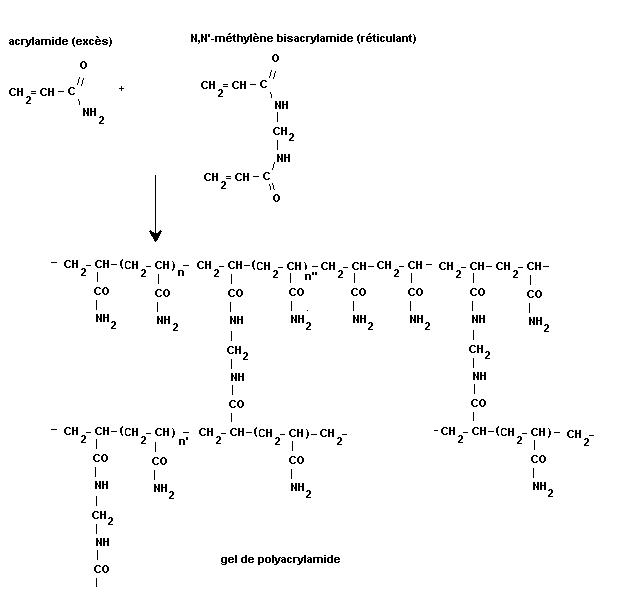
Les gels de polyacrylamide sont obtenus par polymérisation du monomère
acrylamide en présence d'un autre monomère bifonctionnel et donc réticulant, le
N,N'-méthylène bisacrylamide (ou un équivalent).
La polymérisation est en général initiée par du persulfate d'ammonium en
présence de l'accélérateur TEMED (N,N,N',N'-tétraméthylènediamine). Le TEMED
(sous sa forme basique, ce qui implique un pH suffisamment élevé) catalyse la
formation de radicaux libres à partir du persulfate. Les radicaux libres
initient la polymérisation. On peut aussi utiliser la décomposition par la
lumière de la riboflavine-phosphate qui donne alors naissance à des radicaux
libres.
L'oxygène étant un inhibiteur de polymérisation, les solutions de monomères
devraient donc être dégazées avant d'être mises à polymériser.
Généralement, on "coule" le mélange acrylamide/bisacrylamide/solution tampon choisie/réactifs d'initiation de polymérisation dans un volume défini par deux plaques de verre et des intercalaires de faible épaisseur. La polymérisation est terminée en quelques minutes.
La porosité des gels obtenus dépend de la concentration totale en monomères
et de la proportion d'agent monomère réticulant (le bisacrylamide).
En général, on appelle T (exprimé en %) la concentration totale en monomères :
%T = (a+b)*100/v
avec a masse d'acrylamide en g, b masse de bisacrylamide en g et v volume total
de solution en mL.
On appelle généralement C la proportion d'agent réticulant :
%C = b*100/a
La porosité diminue quand %T augmente.
Jusqu'à la valeur limite %C=5%, la porosité diminue quand %C augmente.
Au delà de %C = 5%, le bisacrylamide polymérise beaucoup sur lui-même , entraînant
la formation de gels à porosité hétérogène.
Les gels avec %T=2,5% (une limite inférieure de solidité) sont convenables
pour séparer avec effet de tamisage moléculaire des protéines de masses
moléculaires aux alentours de 1 million de Daltons. Les gels avec %T=30% sont
convenables pour des peptides vers 2000 de masse moléculaire. Des tables
fournissent les capacités de séparation des gels en fonction de %T et %C. Les
gels avec gradient de concentration en acrylamide ont des résolutions très
élevées.
|
Pour %C = 2,67% |
|||||
Valeur de %T |
T% = 5% |
T% = 7,5% |
T% = 10% |
T% = 12% |
T% = 15% |
Domaine de résolution des unités polypeptidiques |
100 à 500 kDa |
65 à 200 kDa |
21 à 200 kDa |
14 à 100 kDa |
6,5 à 100 kDa |
Les deux monomères sont des toxiques très dangereux. Ainsi selon la classification européenne : Toxicité aiguë, Oral(e) (Catégorie 4) ; Toxicité aiguë, Inhalation (Catégorie 2) ; Irritation cutanée (Catégorie 2) ; Irritation oculaire (Catégorie 2) ; Sensibilisation respiratoire (Catégorie 1) ; Sensibilisation cutanée (Catégorie 1) ; Mutagénicité sur les cellules germinales (Catégorie 1B) ; Cancérogénicité (Catégorie 1B) ; Toxicité pour la reproduction (Catégorie 2) ; Toxicité spécifique pour certains organes cibles - exposition répétée (Catégorie 1).
La valeur limite d'exposition professionnelle (VLEP) sur 8 heures est de 0,3 mg/m3 en France et 0,03 mg/m3 aux USA. La DL50 est de 107 mg/kg par voie orale chez la souris.
Au laboratoire, les conditions d'utilisation de l'acrylamide et du bisacrylamide doivent être très rigoureuses :
- personnel formé et informé ;
- manipulaton des formes poudres à substituer au profit des solutions commerciales concentrées. Stockage : au réfrigérateur, en flacon étanche ;
- salle dédiée ; verrerie, pipettes ... dédiées, et réputées contaminées ;
- élimination des déchets : voie d'incinération avec postcombustion ;
- protections individuelles : blouse dédiée, lunettes faciales, gants nitrile .
(voir par exemple la fiche toxicoloique de l'INRS http://www.inrs.fr/accueil/produits/bdd/doc/fichetox.html?refINRS=FT%20119 et les feuilles de données de sécurité des revendeurs (fiches MSDS material safety data sheet) sur leurs sites.