Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2020
[A propos de l'auteur]
[Droits de copie]
![]()
Pour aborder le phénomène de concentration des micelles SDS-unité polypeptidique dans les montages SDS-page avec gel de concentration et système discontinu de tampons, il est nécessaire de connaître le phénomène d'isotachophorèse. Ce phénomène est présenté dans le premier paragraphe qui suit, puis le deuxième paragraphe montre comment il est appliqué en SDS-page avec gel de concentration.
Soit le montage suivant :
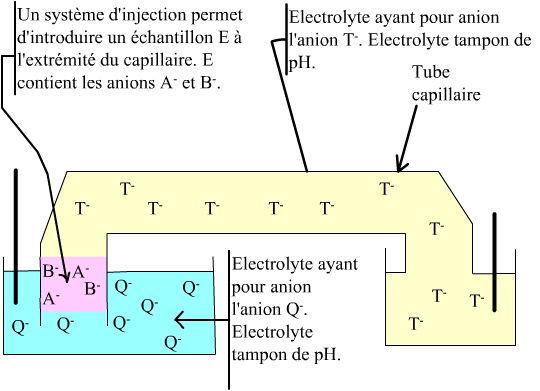 |
La mobilité (symbole µ) des différents
ions est la suivante : Et on suppose que les cations de l'électrolyte possèdent une capacité tampon suffisante pour maintenir le pH |
Appliquons au système une tension électrique V.
Les ions Q-, T-, A- et B- migrent vers le pôle positif. Mais, le
système électrolytique n'étant pas pas homogène, on constate que le champ
électrique n'est pas homogène uniforme
dans le système :
• il existe une valeur de champ dans la zone où les ions Q- sont seuls EQ,
• il existe une valeur de champ dans la zone où les ions T-sont seuls ET,
• il existe une valeur de champ dans la zone de mélange EM.
|
On peut montrer et observer qu'il va se passer alors des phénomènes intéressants : |
|
• 1 |
les ions Q et T vont migrer à la même vitesse et
encadrer la zone de présence de A et B. On aura : |
• 2 |
Les ions A et B, vont se séparer petit à petit.
Les ions B se regroupent devant A et le champ électrique
dans la zone de mélange devient non homogène.
Lorsque les A et les B seront totalement séparés on
aura une valeur de champ pour la zone des A (EA) et
une dans la zone des B (EB). |
• 3 |
On peut aussi s'intéresser à un autre phénomène, celui de l'intensité du courant électrique. L'intensité est la même en toute section de la veine liquide. Ceci à une conséquence intéressante : si on utilise des solutions d'ions de tête (T-) et de queue (Q-)concentrées (donc favorisant une intensité de courant élevée), elles vont conduire à la concentration des ions A- et B- au sein de leurs domaines respectifs. L'isotachophorèse permet de concentrer éventuellement les ions "empilés" entre la frontière de tête et celle de queue. |
On peut shématiser l'évolution de l'isotachophorèse ainsi :
|
Etat initial |
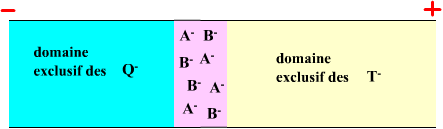 |
|
Etat préstationnaire |
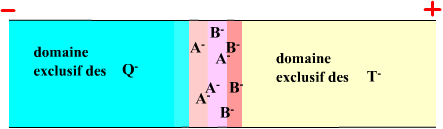 |
|
Etat stationnaire |
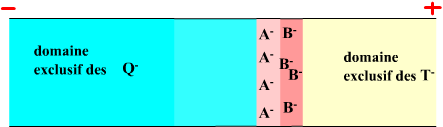 |
On va expliquer le fonctionnement du système de concentration en supposant l'utilisation du système de
tampons suivant :
• tampon de migration aux 2 bacs d'électrodes : [Tris-HCl] = 25 mmol/L ; [glycine] = 192 mmol/L ; [SDS] = 1 g/L ; pH =8,3.
• tampon de concentration : le gel de concentration (en général %T = 3% et %C = 2,67%) est
imprégné en tampon [tris-HCl] = 0,125 mol/L pH 6,8
avec [SDS] = 1 g/L .
• tampon de résolution : le gel de
résolution est imprégné en tampon [Tris-HCl] = 0,375 mol/L pH 8,8 avec- [SDS] = 1 g/L
• les échantillons protéiques sous forme de
micelles SDS-unités polypeptidiques (micelles SDS-UP) sont
en tampon Tris-HCl pH 6,8 avec glycérol, SDS,
2-mercaptoéthanol et marqueur coloré anionique comme le bleu de bromophénol (BBP).
|
Examinons la situation lors de la mise sous tension du système. |
Les anions du gel de concentration (en
jaune clair) et de résolution (en
jaune plus foncé) sont des chlorures Cl- de
forte mobilité (µCl-) (symbole =
en
orange). |
 |
|
Si on applique ce qu'on a vu en isotachophorèse, on va obtenir le résultat suivant : il va se former un "train d'ions". Le domaine des chlorures avance suivi par le BBP puis les SDS-UP puis par la zone des glycinates". |
Comme les ions chlorures et glycinates des zones de tête et de queue sont concentrés, les micelles SDS-UP vont se concentrer dans leur zone qui va devenir très fine. Et voilà ! A partir d'un dépôt de volume relativement élevé dans le puits, on va obtenir une bande très fine de micelles SDS-UP derrière une bande très fine de colorant BBP. Conclusion : les micelles SDS-unités polypeptidiques
(micelles SDS-UP) arrivent au niveau du gel de séparation
très concentrés selon un "train
résultat d'isotachophorèse". Ce train est le suivant : |
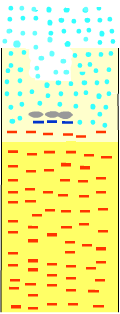 |
|
Puis le BBP et les micelles SDS-UP et les glycinates vont pénétrer dans le gel de résolution. |
Mais le pH du gel de résolution n'est pas de 6,8 mais
de 8,8. Ceci n'a aucune conséquence sur la charge des ions
chlorures, du BBP et des micelles SDS-UP donc aucune
conséquence sur leur mobilité. En revanche cette
élévation de pH modifie considérablement la charge nette moyenne des glycinates qui prend désormais
pour valeur 0,9 charge élémentaire négative
(contre 0,1 à pH 6,8). La mobilité des ions
glycinate s'en trouve considérablement augmentée !
Et elle devient supérieure à celle des micelles
SDS-UP (fallait y penser et le mettre au point !). Et donc les
ions glycinate vont passer devant les micelles SDS-UP. Le nouvel
empilement d'isotachophorèse va devenir : le domaine des
chlorures puis le domaine assez fin du marqueur BBP puis le le
vaste domaine des ions glycinate dans lequel les micelles SDS-UP viennent de basculer. Les micelles SDS-UP se retrouvent "simples
ions échantillons pas rapides" au sein d'une zone
électrolytique glycinate (de pH 8,8) qui progresse vers le
pôle positif (la frontière
Cl-/BBP/glycinate se déplaceant aussi, en tête et plus vite, vers le pôle
positif). Et voilà, fin de l'explication. |
 |