Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2014/2020
[A propos de l'auteur]
[Droits de copie]
![]()
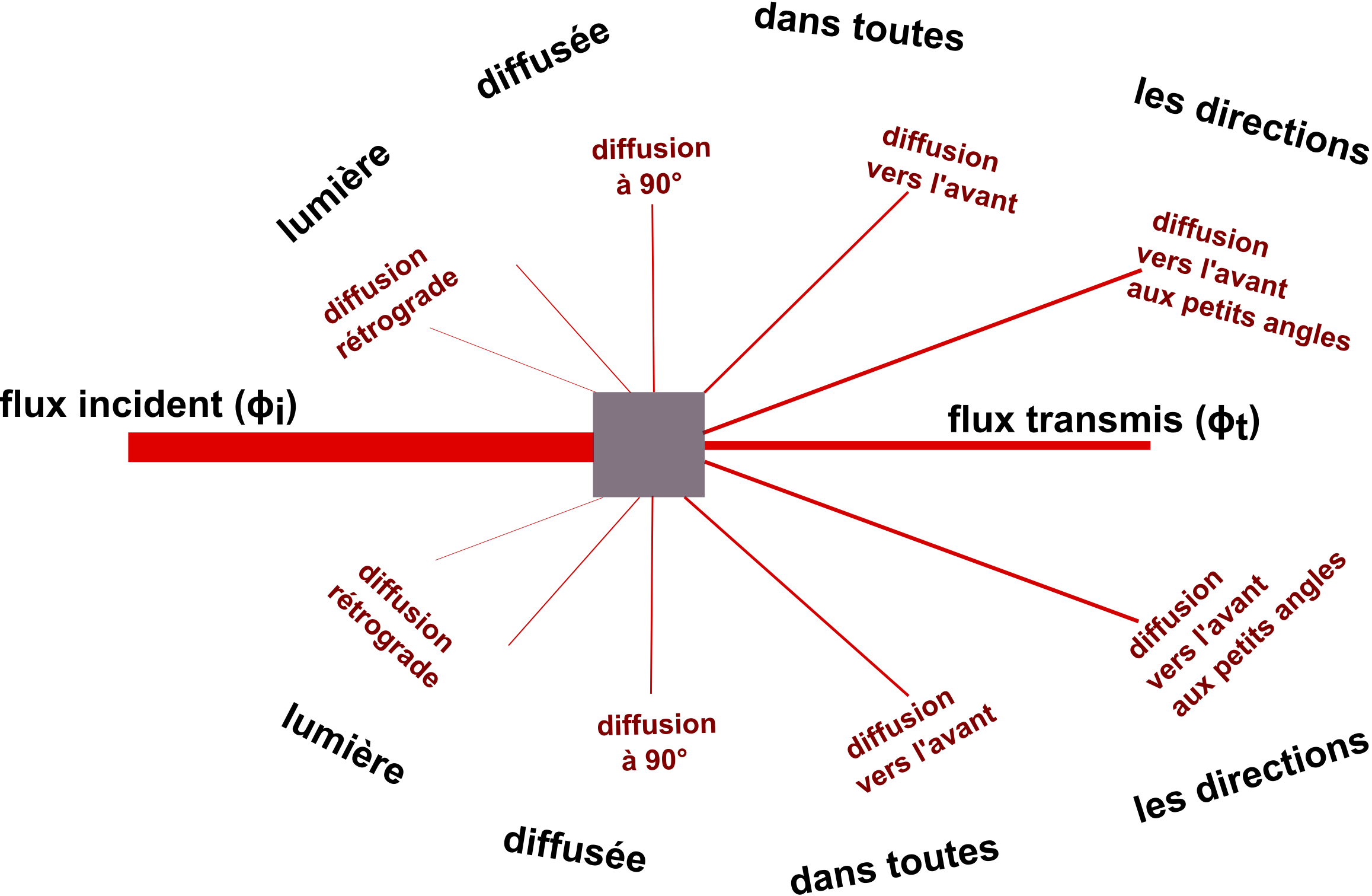
Il est possible d'utiliser un spectrophotomètre visible ou UV-visivble comme opacimètre pour mesurer des concentrations en biomasse. On se place en mode de mesure appelé "absorbance" (A) ou "densité optique" (OD, OD). L'appareil va mesurer le logarithme décimal du rapport du flux de référence au flux transmis. La valeur ainsi affichée compte 2 composantes additives, l'effet du à la biomasse et l'effet du au milieu de culture. L'effet du au milieu de culture correspond à l'absorbance propre des composants du milieu et un éventuel trouble du milieu. La composante OD due à la biomasse est la conséquence de la turbidité due à la biomasse et aussi éventuellement d'une absorbance de "pigments absorbants" de la biomasse.
Selon la terminologie IUPAC, la mesure réalisée est une mesure d'atténuance (symbole recommandé D). Je ne connais pas d'article scientifique de microbiologie qui utilise ce terme en 2020. En pratique, dans la littérature on trouve "optical density" (OD). En français cela donne "densité optique". On rencontre encore parfois le vieux terme "extinction". Sachant que la littérature scientifique est en langue anglaise, et que DO fait généralement référence à "Dissolved Oxygen" le symbole OD pour les densités optiques est peut être à préférer à DO.
A priori, toutes les longueurs d'onde du visible et du proche IR sont utilisables car aux dimensions des micro-organismes, la diffusion est peu dépendante de la longueur d'onde dans ces domaines. Comme les milieux absorbent généralement vers 400-550 nm et peu au delà de 550-600 nm, on mesure généralement avec un éclairage monochromatique au delà de 600 nm.
La relation ODX = f([biomasse]) est linéaire jusqu'à une certaine limite. En général vers 0,5-0,7 de OD, ce qui est peu. Au delà, la courbure en plateau devient très forte. Attention, les valeurs de OD obtenues dépendent de l'appareil utilisé, en effet, le spectrophotomètre va mesurer une partie de la lumière diffusée, celle aux très petits angles avant. Or cette fraction mesurée dépend de la surface du photocapteur et de son éloignement de la cuve de mesure ! Il faut donc étalonner son appareil... Même si en pratique les spectrophotomètres classiques du commerce donnent des résultats proches et ainsi on peut utiliser des règles du type "0,1 de OD pour environ 2. 108. bactéries par mL chez les entérobactéries".
Ci-dessous un exemple d'étalonnage de la relation [biomasse]=f(OD) chez E.coli avec un spectrophotomètre monofaisceau standard
Mesures à 600 nm.
On a utilisé une culture de la nuit qui a été numérée par comptage d'unités formant colonies après culture (UFC) et a donné 3,4 109 UFC par mL.
Les mesures de OD sur une série de dilutions (pour la seule composante de biomasse, donc après soustraction de la composante milieu de culture) conduisent au graphe suivant :
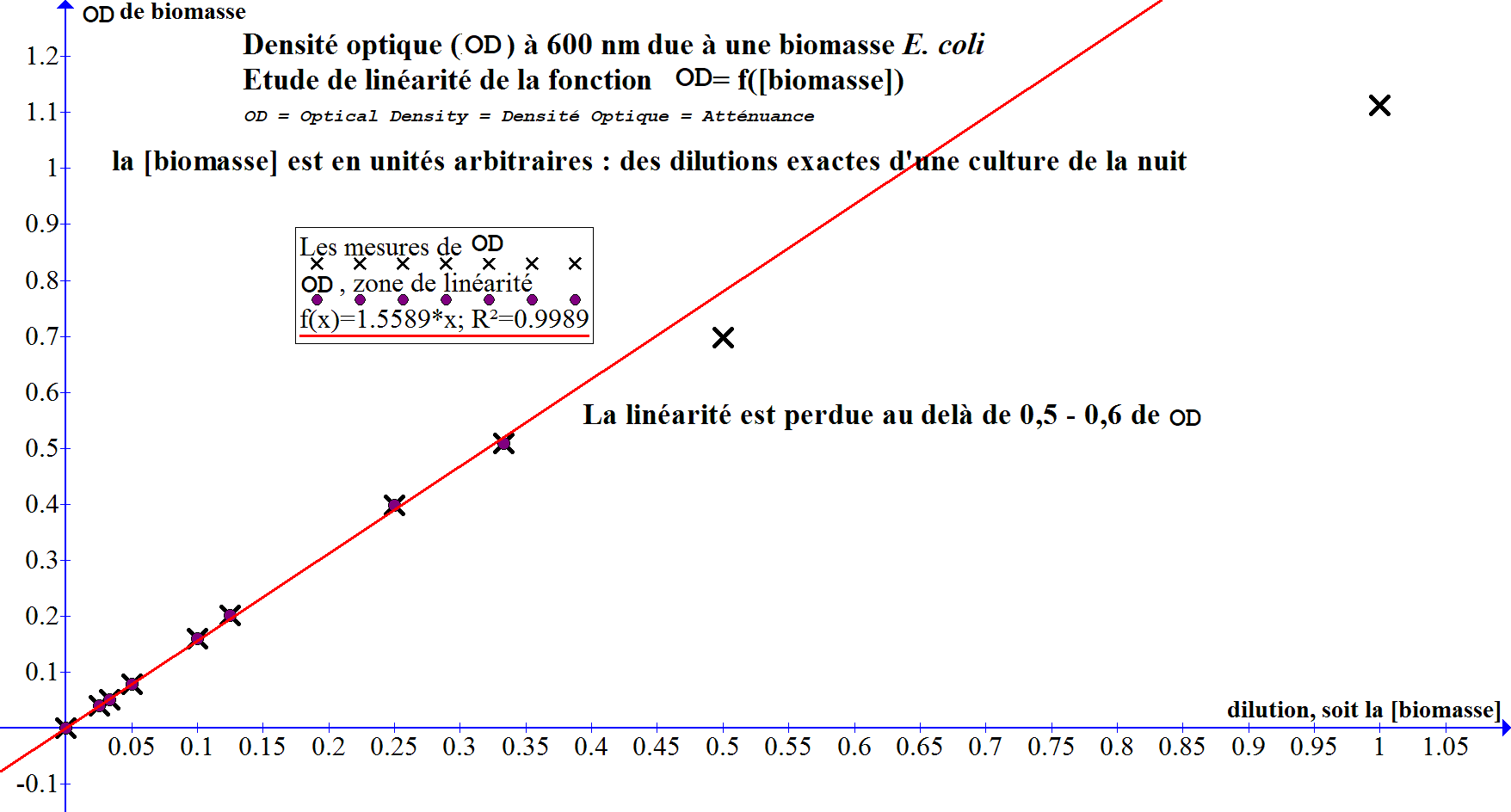
Selon l'équation de la fonction OD=f([biomasse]) dans la zone de linéarité, on devrait avoir 1,56 de OD pour la culture non diluée (si la relation était linéaire à l'infini). Comme la culture non diluée a été mesurée à 3,4 109 UFC par mL, on dira que 1 de OD correspond à 3,4/1,56 ≈ 2,2 109 UFC par mL avec une limite de linéarité vers 0,5-0,6. Par convention la OD de la culture non diluée sera donnée à 1,56.
Voir aussi le §3 avec le menu de gauche.
Remarque importante : Des fabricants commercialisent des "sondes de biomasse" autoclavables utilisant un éclairage NIR (proche infra-rouge vers 850 à 950 nm) et des mesures de lumière transmise et une transmission par fibre optique.