Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2004-2014
[A propos de l'auteur]
[Droits de copie]
Dans le monde des bactéries (Eubacteria), on rencontre (mais pas seulement) deux grands types d'enveloppes qui correspondent à deux grandes branches phylogéniques : le bactéries monodermes (dites aussi "gram positives") et les bactéries didermes à LPS (dites aussi "gram negatives"). Les monodermes seraient plus "ancestraux".
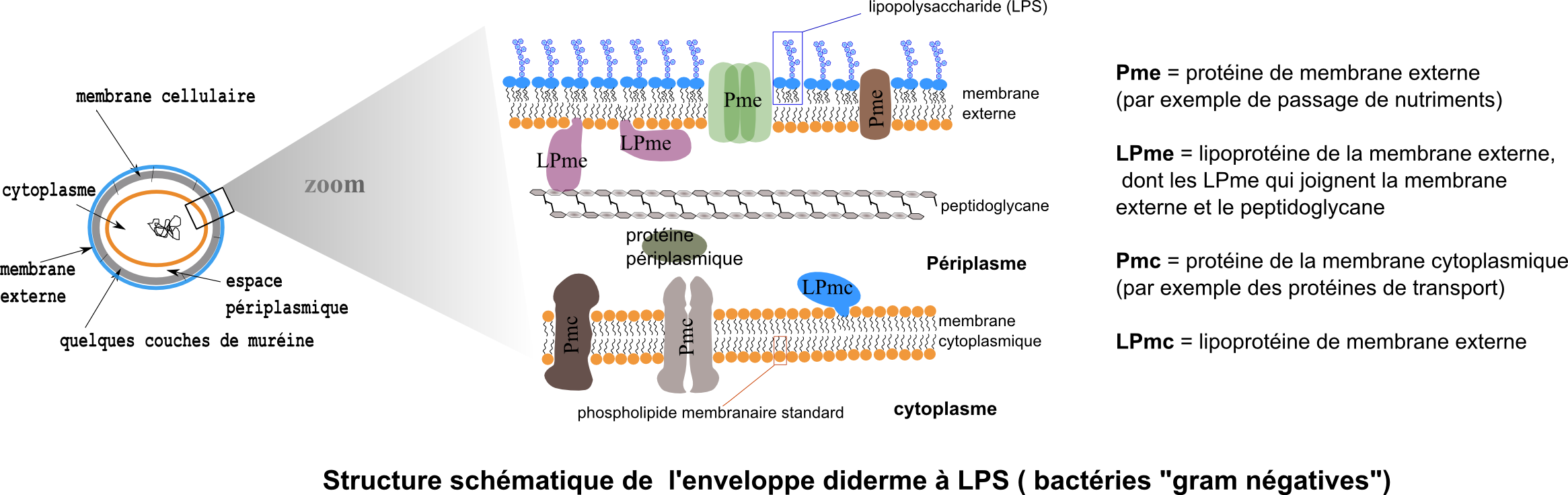
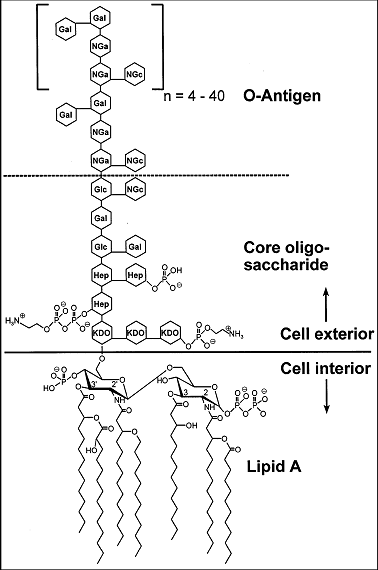
La membrane externe typique des didermes à LPS est une membrane dont le feuillet externe est assemblé avec un lipide particulier : le lipopolysaccharide (LPS) dont voici la structue, figure de droite, d'après J Pharm Pharmaceut Sci (www.cspscanada.org) 10(3):388-404, 2007 Structure chimique du LPS d'E. coli O111:B4. (Hep) L-glycerol-D-manno-heptose; (Gal) galactose; (Glc) glucose; (KDO) 2-keto-3-deoxyoctonic acid; (NGa) N-acetyl-galactosamine; (NGc) N-acetyl-glucosamine
Le LPS élément structurant de la membrane externe a des propriétés
remarquables : L'article en.wikepia donne aussi une bonne documentation : http://en.wikipedia.org/wiki/Lipopolysaccharide |
 |
Le peptidoglycane des bactéries gram-négatives classiques est tout à fait semblable à celui de la plupart des bacilles gram positifs. Il est caractérisé par le pontage avec l'acide aminé "acide méso-diaminopimélique" (DAP), ce qui est un peu différent du pontage qui a été présenté au paragraphe 2 précédent et qui - lui - était plutot caractéristique de nombreux coques gram positifs. Le schéma à droite, issu de Julien Royet & Roman Dziarski Nature Reviews Microbiology 5, 264-277 (April 2007) montre cette subtilité. Le DAP a pour structure 2HN(COOH)HC - CH2 - CH2 - CH2 - C(H)NH2 - COOH. Les fonctions -NH2 et COOH de la chaîne latérale de cet acide aminé permettent ainsi la création d'un pontage peptidique comme le montre le schéma. |
|
Les lipoprotéines de la membrane externe sont remarquables par leur fonction d'attachement entre la membrane externe et le peptidoglycane (attachement covalent au peptidoglycane).
L'espace périplasmique contient des protéines sécrétées. Une des plus connues est la phosphatase alcaline de E.coli.
Les porines (trimères de 3 sous-unités accolées) sont des protéines essentielles de la membrane externe (une membrane dont la structure phospholipidique de base est potentiellement imperméable aux molécules hydrophiles à l'image d'une membrane cytoplasmique). Les porines forment des canaux de diffusion plus ou moins spécifiques pour les petites molécules hydrophiles aussi bien nutriments (sucres, ions, aminoacides ...) que déchets divers. 1500 Da est une limite de taille. La membrane cytoplasmique forme la deuxième barrière sélective.
Application médicale. Chez les bactéries gram-négatives, les antibiotiques de la classe des ß-lactames atteignent leurs cibles (les transpeptidases) après entrée par des porines particulières. Certaines résistances sont dues à des mutations chez ces porines, soit leur diminution en nombre, soit la non permission du passage de l'antibiotique.
L'enveloppe peptidoglycane des bactéries didermes n'est formée que de très peu de couches de peptidoglycane au contraire des multicouches très épaisses de la plupart des bactéries monodermes. C'est ce qui conduit ainsi à l'aspect "Gram-" à la coloration de Gram : la décoloration à l'alcool ou au mélange acétone-alcool pratiquée à la suite de la première étape de coloration au cristal violet et au mordançage à l'iode ioduré est très rapide chez les didermes (la membrane externe ne résiste pas à un lavage à l'alcool et le peptidoglycane peu épais retient mal le complexe colorant cristal violet / iode-ioduré) et beaucoup plus lente chez la plupart des monodermes. Les didermes sont ainsi décolorés de façon différentielle avant d'être contre-colorés en rose par la safranine.
Le lysozyme hydrolyse les liaisons β-1-4 entre la N-acetyl-glucosamine (NAG) et l'acide N-acetyl-muramique (NAM) de la muréine est très utilisé au laboratoire pour "digérer" la fraction peptidoglycane de la paroi. On peut l'associer avec des détergennts et des chélatants (EDTA, acide éthylènediaminetétraacétique) pour désorganiser les membranes.
La membrane externe est beaucoup plus sensible à la déstabilisation par les chélatants des cations métalliques (ils équilibrent les répulsions électrostatiques dans les zones de surfaces polaires de la membrane, notamment au niveau du feuillet à LPS). Cette propriété peut être utilisée pour extraire les seules protéines périplasmique par la technique dite du "choc-osmotique" : après séjour en milieu hyperosmotique, et en présence dEDTA, les cellules sont remises en suspension en milieu hypo-osmotique. Lentrée deau consécutive craque la membrane externe et provoque une expulsion des protéines périplasmiques alors que la membrane cytoplasmique reste préservée.
La paroi est en perpétuel remaniement. Une dynamique indispensable pour les phénomènes de division et de croissance en taille et qui détermine la forme des bactéries.
La division bactérienne est traitée à http://www.perrin33.com/microbiologie/lereste/divisiondesbacteries.html.
La synthèse du peptidoglycane de paroi et son remaniement dynamique constant fait appel à des peptidases (carboxypeptidases) et des transpeptidases. Celles-ci sont les cibles des antibiotiques de la famille des β-lactames (dont les célèbres pénicillines). La biosynthèse du peptidoglycane et les antibiotiques β-lactames son traités à http://www.perrin33.com/microbiologie/lereste/lactam_2.php.