Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2015-2021
[A propos de l'auteur]
[Droits de copie]
La solubilité en solution aqueuse d'une protéine globulaire est liée à ses groupements chimiques de surface. Les zones de surface au contact de l'eau d'une protéine sont soit :
- hydrophobes (quand elle présente au contact de l'eau des groupements apolaire comme ceux retrouvés dans les chaînes latérales de la valine, leucine, proline, phénuylalanine ...) ;
- hydrophiles (quand elle présente au contact de l'eau des groupements chargés ou polaires comme -COO-, NH3+, -OH retrouvés dans les chaînes latérales des acides aminés aspartate, lysine, sérine ... ) ;
Les motifs de surface responsables de la solubilité dans l'eau sont évidemment les motifs hydrophiles (par interactions électrostatiques avec l'eau - polaire - et/ou par liaisons hydrogène avec l'eau). Les zones hydrophobe au contact avec ll'eau
sont "défavorables" à la solubilisation et créent à leur contact des "cages" d'eau où les molécules d'eau en contact avec la protéine ont moins de laisons hydrogènes avec leurs voisines que celles au coeur de la phase aqueuse.
Si on élève fortement la concentration en sel non chaotropique (en sulfate d'ammonium par exemple), l'eau disponible pour la solubilisation d'une protéine va diminuer - elle est "détournée" vers la solvation du sulfate et de l'ammonium - et la protéine va former des aggrégats protéiques, essentiellement par interactions hydrophobes entre les zones hydrophobes de surface. Plus la surface d'une protéine présente de résidus hydrophiles par rapport aux zones de surface hydrophobes, plus la concentration en sulfate d'ammonium nécessaire pour sa précipitation sera élevée. Avec un sel non chaotropique comme le sulfate d'ammonium, à basse température, la protéine demeurera à l'état natif.
Note. La physique du salting-out est très complexe et fait intervenir un effet entropique au niveau des zones hydrophobes de surface pour la formation des agrégats : lors de l'agrégation aux surfaces hydrophobes, il y a diminution des cages d'eau donc effet entropique favorable (positif). C'est très complexe... On peut rester empirique.
Le schéma ci-dessous propose l'allure générale du diagramme de précipitation, relargage (salting-out) des protéines globulaires hydrosolubles par le sulfate d'ammonium et le principe de la purification par précipitation fractionnée :
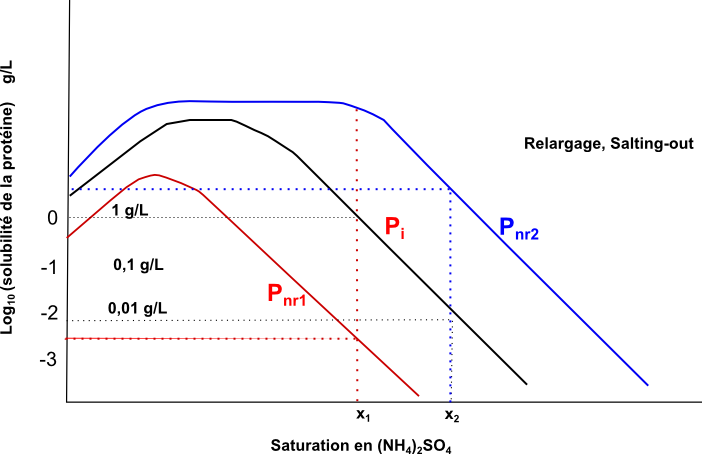 |
Soit un extrait à 3 protéines Pi, Pnr1 (proposant de nombreuses zones hydrophobes de surface) et Pnr2 (particulièrement hydrophile).
Soit Pi la protéine d'inétrêt à purifier. Soit par exemple x1=31% et x2=39% |
La démarche de purification partielle d'une protéine P d'un extrait brut par précipitation fractionnée au sulfate d'ammonium est donc généralement la suivante :
- traitement à un taux de NH42SO4 le plus élevé possible conservant P soluble mais précipitant le plus possible d'autres protéines ;
- centrifugation, récupération du surnageant ;
- traitement à un taux de NH42SO4 le plus bas possible précipitant l'essentiel de P mais gardant solubles le plus possible d'autres protéines ;
- centrifugation, récupération du culot, remise en solution ;
- dessalage, changement de tampon, concentration éventuelle pour la suite des opérations de purification.
Attention, la précipitation dépend beaucoup de l'état d'ionisation des groupements de surface donc du pH ! On s'en doutait ...
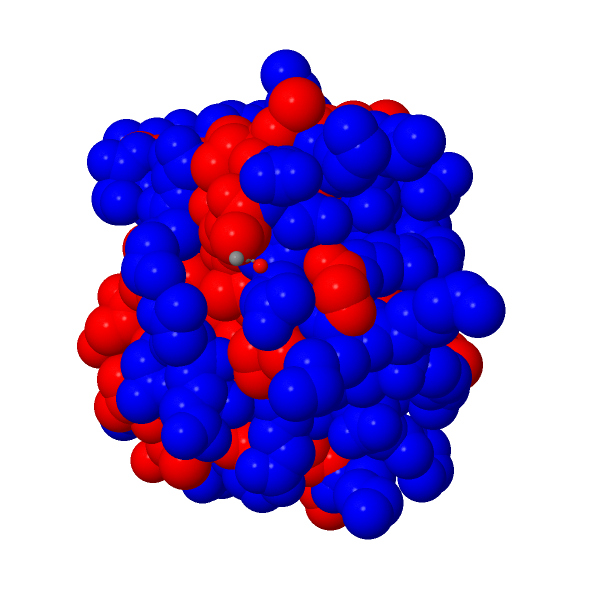
Remarque. Voici 2 images de protéines cytochrome c et lysozyme (issues de www.rcsb.org, animation Jmol). Les surfaces hydrophobes sont en rouge. Le cytochrome c qui propose une proportion de surface hydrophobe plus faible que le lysozyme précipite à des taux de sulfate d'ammonium plus élevé que le lysozyme (source = http://www.gelifesciences.com/webapp/wcs/stores/servlet/CategoryDisplay?categoryId=1102794&catalogId=10101&productId=&top=Y&storeId=11761&langId=-1 consultation mars 2015).
Attention, le volume final de solution va augmenter sous l'effet d'ajout du sulfate d'ammonium.
Ou un bon calculateur à : http://www.encorbio.com/protocols/AM-SO4.htm