Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2015-2021
[A propos de l'auteur]
[Droits de copie]
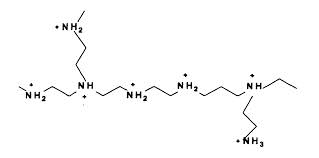 Structure d'un PEI et charges (amines protonées) aux pH biologiques.
Structure d'un PEI et charges (amines protonées) aux pH biologiques.
Les PEI lient les macromolécules chargées négativement comme les acides nucléiques et les protéines acides en formant un réseau PEI/macromolécules négatives qui précipite. Le précipité est récupérable par centrifugation. Les conditions de pH et de force ionique sont évidemment déterminantes. Les forces ioniques élevées défavorisent le phénomène. Ainsi, par exemple, une protéine moyennement acide qui se lie au PEI et précipite à 0,1 M en NaCl, sera éluée du PEI à 0,4 M en NaCl. Elle retournera alors soluble (ainsi que le PEI). En revanche, une autre protéine très acide, précipitera encore au PEI à 0,4 M en NaCl et n'en sera éluée qu'à 0,9M.
• Le PEI est utilisé pour précipiter les acides nucléiques à haute force ionique (1 M NaCl) en gardant les protéines solubles. Il faut plus de 1,5 M en NaCl pour éluer les acides nucléiques du PEI.
• Le PEI est utilisé à faible force ionique (0,1 M NaCl) pour précipiter les acides nucléiques et les protéines très acides en gardant les autres protéines solubles. on a là une stratégie de précipitation fractionnée. La protéine d'intérêt se retrouvera alors dans la phase soluble ou le précipité ... On pourra récupérer une protéine d'intérêt dans le précipité en l'éluant à haute force ionique (genre 0,9 M). Attention, il faudra "nettoyer" la fraction protéique du PEI soluble. On peut le faire en précipitant à très haute teneur en sulfate d'ammonium, le PEI reste soluble.
Les PEG sont des polymères hydrophiles non ioniques. En solution, ils vont lier des molécules d'eau (on pourrait utiliser l'image d'une éponge à eau) et si la concentration est très élevée ils vont "déplacer" l'eau de la couche de solvatation qui entoure les protéines. Avec pour conséquence des interactions protéine-protéine et leur précipitation.
Elles sont parfois possibles, en travaillant à basse température pour éviter les dénaturations.
Un exemple historique - et toujours d'actualité - est celui du fractionnement des protéines du plasma en joant sur la concentration en sel, en éthanol (de 8 à 40% classiquement) et le pH.
Ces méthodes ont été initiées par le biochimiste américain Edwin Cohn.