Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour mars 2021
[A propos de l'auteur]
[Droits de copie]
![]()
Voici un exemple de "chimie historique et classique au bromure de cyanogène" permettant d'activer et de fixer un ligand (petite molécule ou protéine) présentant une fonction amine à un support agarose
Après conjugaison du ligand choisi (qui doit porter une fonction amine accessible), les sites activés ayant non réagi seront éteints avec un réactif type éthanolamine.
Exemple avec un support polyacrylamide (qui porte donc au départ des fonctions amides en surface), activation, greffage d'un bras espaceur, activation et greffage d'un ligand à fonction amine.
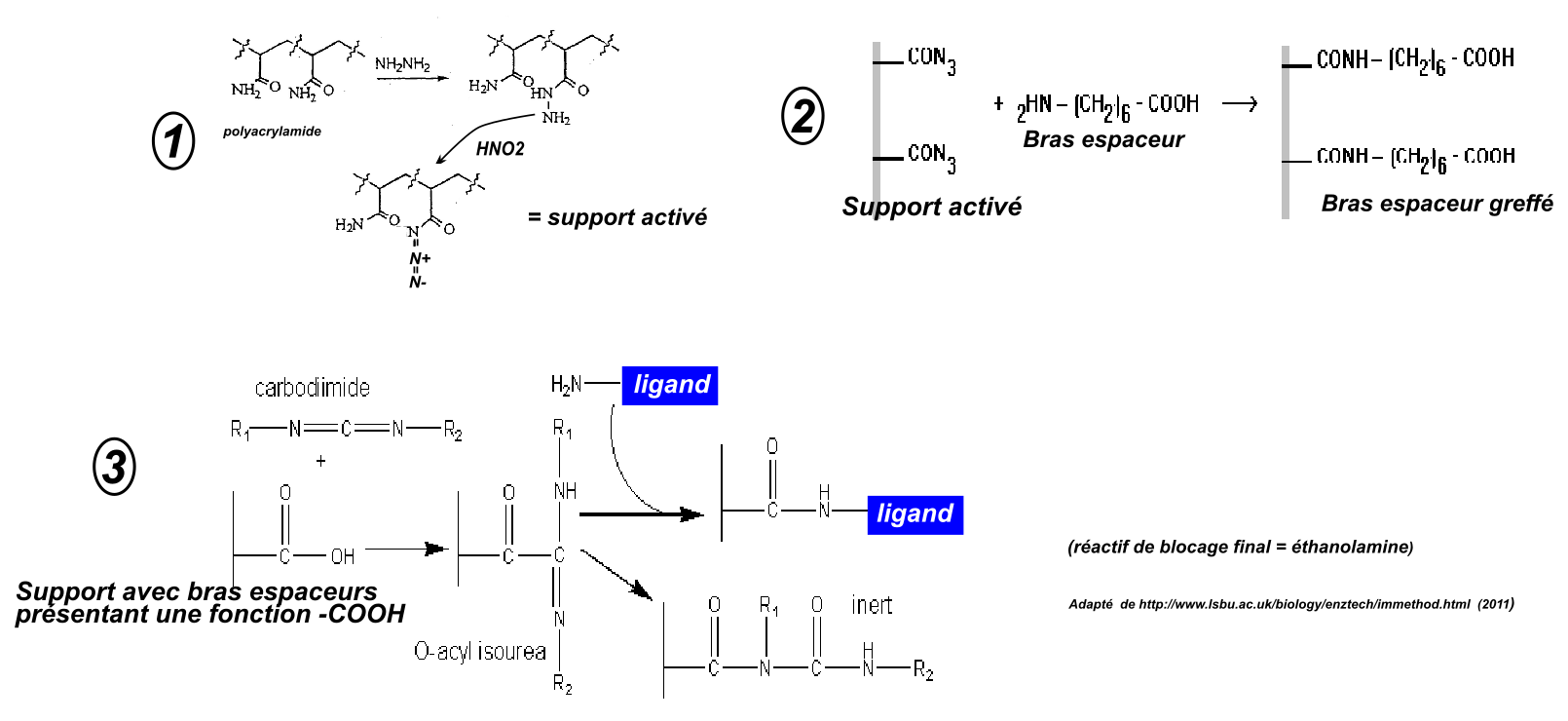
Exemple avec un support polyacrylamide (qui portait donc au départ des fonctions amides en surface) commercialisé déjà activé et utilisable pour conjuguer des ligands à fonction amine.
Après conjugaison du ligand choisi (qui doit porter une fonction amine accessible), les sites activés ayant non réagi seront éteints avec un réactif type éthanolamine.
On a vu au paragraphe 1 les supports classiques prêts à l'emploi pour purifier les protéines recombinées étiquetées. On retiendra les chromatographies IMAC pour les protéines à étiquette 6-his et les supports à glutathion immobilisé pour les protéines à étiquette GST.
Les supports prêts à l'emploi à protéine A ou à protéine G greffée (2 protéines à affinité pour le fragment Fc des IgG) sont commercialisés par de nombreux fabricants. Les supports à bleu cibacron greffé sont aussi commercialisés par de nombreux fabricants. le bleu cibacron fixe de façon très affine la sérumalbumine (chromatographie de nettoyage de l'albumine dans les purifications d'igG) et présente une affinité pour les motifs nucléotidiques ce qui permet son utilisation pour la purification de déhydrogénases à NAD+ aou autres enzymes...
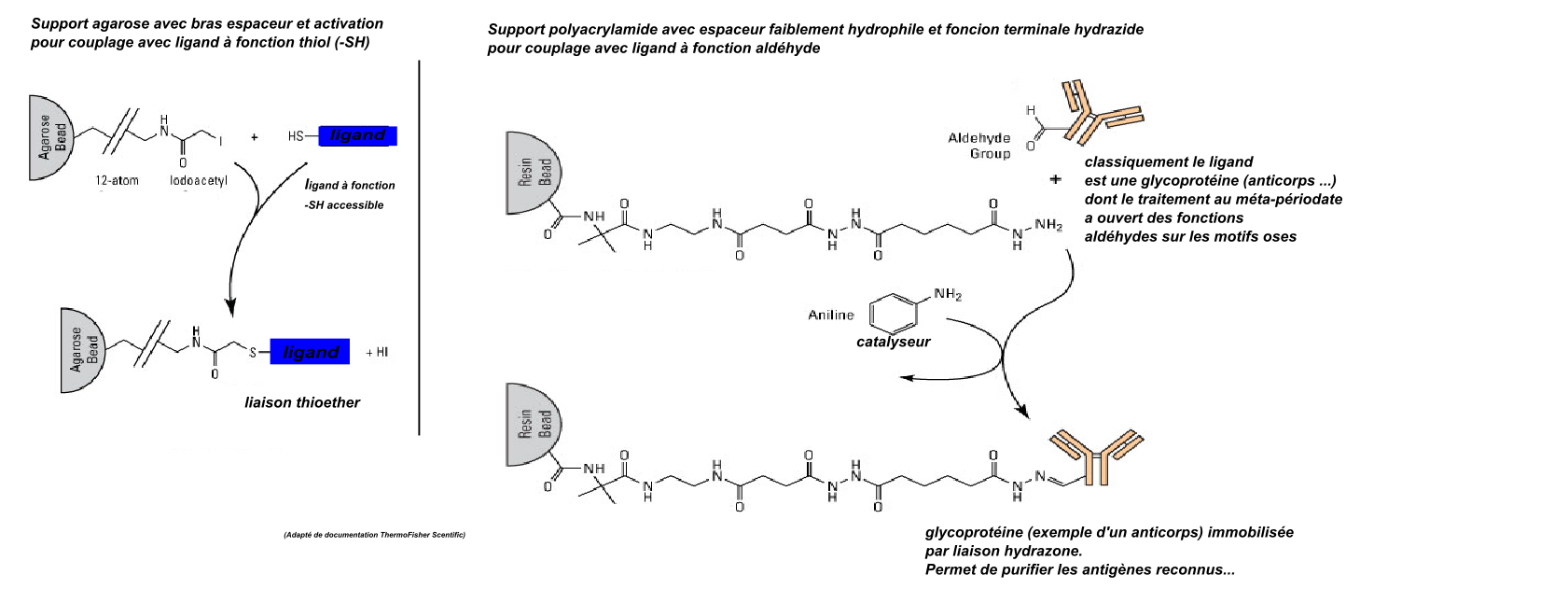
On l'a vu ci-dessus sur 2 exemples, la plupart des supports activés sont des supports réactifs aux fonctions amines. Mais on en trouve des réactifs aux fonctions -SH ou aux fonctions aldéhydes. La réactivité aux fonctions aldéhydes est intéressante puisqu'il est facile de faire apparaître de telles fonctions sur les motifs oses des glycoprotéines par oxydation au périodate.
Pour éluer les protéines retenues (donc la protéine d'intérêt), il y a 2 grandes méthodes en AC :
• l'élution compétition ;
• l'élution par modification des conditions physico-chimiques de milieu.
Elles sont de 2 types selon les 2 schémas ci-dessous.
Par exemple, en IMAC, c'est le deuxième type de compétition qui est très souvent utilisé pour éluer la POI étiquetée 6-his retenue. On va éluer grâce au compétiteur imidazole à concentration élevée qui va chélater le Ni2+ du support et déplacer la POI. La POI sera éluée en présence de l'imidazole (en excès). Une dialyse ou un dessalage par gel filtration ou par diafiltration permettront d'éliminer l'imidazole de la préparation de POI. Le support IMAC devra être rééquilibré par un tampon sans imidazole pour en chasser peu à peu l'imidazole chélaté (de l'eau prendra sa place).
Par exemple, en IMAC, si on abaisse le pH vers 5, on va protoner les N des noyaux imidazoles des histidines (perte de disponibilité du doublet libre de chélation avec Ni2+ du support) et la POI se décroche. Encore faut-il qu'elle supporte pH vers 5...