Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour mars 2021
[A propos de l'auteur]
[Droits de copie]
![]()
La chromatographie IMAC permet de purifier les protéines recombinées portant une étiquette polyhistidine (généralement 6 histidines en N terminal). Cette chromatographie met en oeuvre une phase stationnaire greffée d'un motif chimique complexant des cations métalliques Ni2+ ou Co2+). La spécificité de rétention pour le motif polyhistidine est très bonne mais pas absolue : des protéines peuvent porter en elles-mêmes des motifs susceptibles d'être plus ou moins fortement retenus par la phase stationnaire. On peut évidemment pratiquer cette technique en mode "batch".
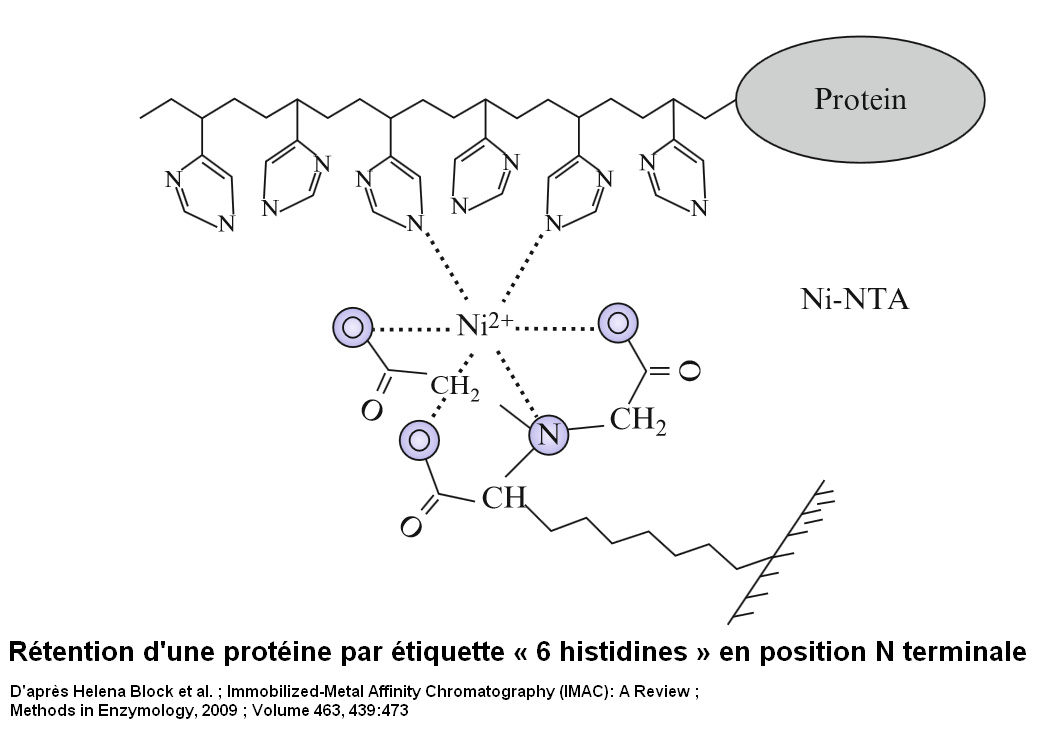
Ni2+ (ou Co2+) peut former des complexes avec 4 ou 6 ligands. On peut l'immobiliser sur des phases stationnaires greffées de motifs chimiques qui pourront le lier avec 4 coordinences et telles que Ni2+ (ou Co2+) ainsi immobilisé puisse réaliser ses 2 dernières liaisons de coordinence avec une étiquette his-6 ajoutée à une protéine à purifier. Les 2 figures ci-dessous présentent une résine « classique » nickel-NTA(nickel- nitrilotriacetic acid). Le motif acide nitriloacétique greffé forme un chelate tétradentate avec Ni2+. Il reste 2 coordinences pour interagir avec les atomes d'azote du cycle de la chaîne latérale de deux résidus histidines.
Certains appellent l'IMAC chromatographie d'affinité cation métallique-chélate, c'est une meilleure appellation que chromatographie d'affinité sur métal immobilisé (Immobilized Metal Affinity Chromatography) mais cette dénomination est peu fréquente.
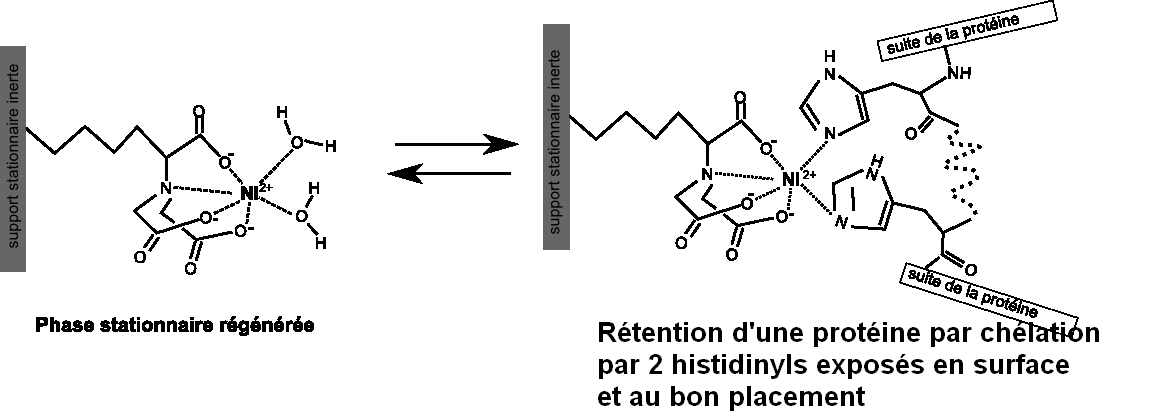
« A possible model is that of an interaction of a metal ion with histidine residues n and n+2 of a His tag. This is confirmed by the fact that IMAC ligands can bind to His tags consisting of consecutive histidine residues as well as to alternating tags. As at least consecutive His tags are usually unstructured and thus flexible, other interaction patterns such as n:n+1, n:n+3, n:n+4, and so on could be imagined as well... » D'après Helena Block et al. ; Methods in Enzymology, 2009 ; Volume 463, 439:473.
Note importante à propos de la liaison de coordinence = liaison de coordination. En approche très simple, elle peut être vue comme une liaison de covalente un peu spéciale et qui serait assez labile : le cation métallique accepte les paires d'électrons de liaison des doublets libres des ligands. Les termes synonymes liaison chélate ou liaison dative sont censés être obsolètes.
les élutions usuelles sont réalisées à l’aide d'un compétiteur : l'imidazole. Le mot imidazole désigne le nom du motif de la cahîne latérale de l'histidine. Donc on comprend facilement l'effet compétiteur.
Les élutions en mode gradient sont recommandées.
En dessous de pH <6 les résidus histidines vont se protoner (le doublet libre de N devient ainsi indisponible pour établir une liaison de coordinence avec Ni2+) et ne pourront plus lier le nickel. On pourrait donc utiliser une variation de pH vers les pH acides pour éluer. Ce n'est pas classique.
La sélectivité pour l'étiquette his-6 n'est pas parfaite. « In E.coli, the proteins observed to copurify with His-tagged target proteins can be divided into four groups: (i) proteins with natural metal-binding motifs, (ii) proteins with histidine clusters on their surfaces ... » (Pour de telles protéines, une colonne Ni-NTA peut servir de colonne d'affinité même sans l'ajout d'une étiquette...)
Le nickel peut être chélaté par l'EDTA ou l'EGTA, aussi ces composés doivent être utilisés avec parcimonie.