Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour octobre 2016
[A propos de l'auteur]
[Droits de copie]
Les ions H3O+ et HO- (le pH) sont des effecteurs de l'aptitude catalytique des enzymes. Une variation de pH peut conduire en ce qui concerne l'aptitude catalytique d'une enzyme donnée à 2 types d'effets :
Effets réversibles/irréversibles s'expliquent très simplement par le fait qu'aux pH extrêmes les enzymes perdent leur structure tridimensionnelle vers les formes être dénaturées et que la dénaturation est irréversible dans les conditions habituelles de laboratoire. Évidemment, selon les enzymes les pH extrêmes seront plus ou moins acide et plus ou moins alcalins.
Dans la suite on s'intéresse aux effets du pH dans les zones de pH ou les effets sont réversibles et on verra les effets sur le coefficient catalytique (k0) et sur le coefficient de Michaelis (Km).
Résumée d'une autre façon, la situation d'une enzyme devant des variations de pH est la suivante :
Expérimentalement, il n'est pas si facile que ça de faire varier le seul paramètre pH d'un milieu réactionnel. En effet, dans un milieu réactionnel, le pH est déterminé par un tampon réalisé avec un(des) couple(s) acide/base. Et ainsi, il faut se méfier d'effets pouvant être liés à des variations de composition des constituants des tampons eux-mêmes si on désire explorer une large gamme de pH impliquant un changement des constituants des systèmes tampons.
Ci-dessous, quelques éléments montrant une étude de stabilité au pH d'une enzyme (effets réversibles ou irréversibles ?) (Morley, Thomas J. et al. "A New Sialidase Mechanism: BACTERIOPHAGE K1F ENDO-SIALIDASE IS AN INVERTING GLYCOSIDASE." The Journal of Biological Chemistry 284.26 (2009): 17404-17410).. Et on verra qu'une étude de stabilité au pH implique de mentionner le temps de séjour aux différents pH testés. En effet, si la dénaturation va être très rapide aux pH très extrêmes, on va trouver des pH frontières avec des effets dénaturants à évolution lente
L'enzyme étudiée ici est une endo-sialidase du bactériophage K1...
Enzyme = bacteriophage K1 endosialidase = endoNF ; réaction = hydrolyse du substrat (Sia3-TFMU) qui est un trimère d'acide sialique acid lié par liaison osidique à l'aglycone trifluoromethylumbelliferyl ;
produit de réaction = trifluoromethylumbelliferyl libre (coumarine) qui absorbe à 380 nm. |
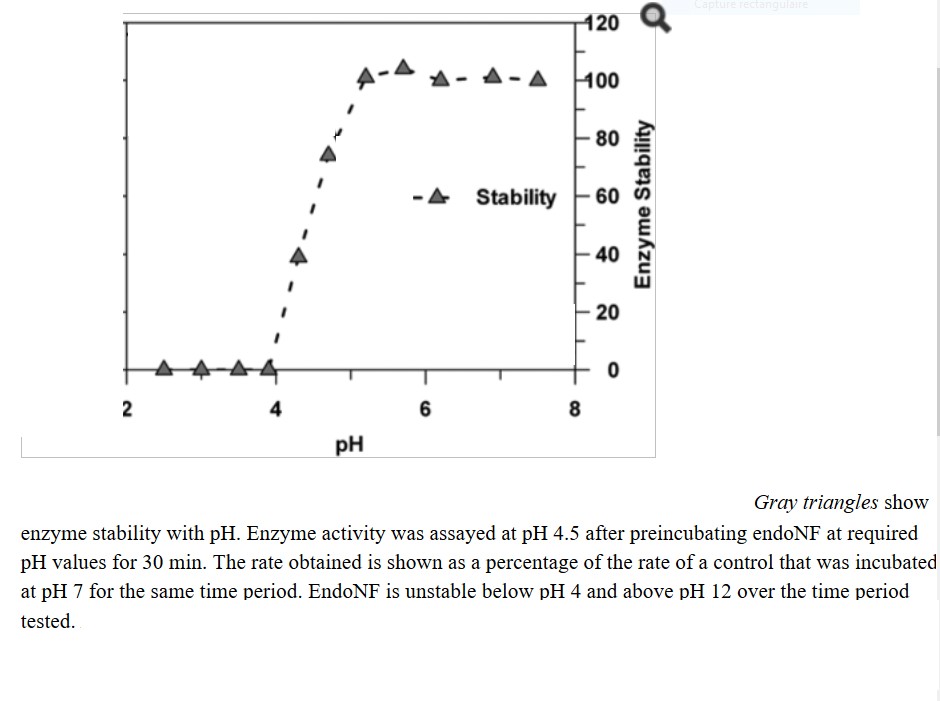
Il apparaît qu'en 30 minutes, l'enzyme est parfaitement stable au dessus de pH 5 et jusqu'à au moins pH 8. En dessous de pH 4, l'enzyme est totalement dénaturée en moins de 30 minutes. Entre pH 4 et 5, la stabilité de l'enzyme est médiocre, ainsi vers pH 4,5 la moitié de l'enzyme est dénaturée en 30 minutes. |