Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour octobre 2016
[A propos de l'auteur]
[Droits de copie]
Dans sa zone de stabilité aux différents pH à laquelle elle peut être exposée, l'effet du pH sur le coefficient catalytique de la ribonucléase A est très facilement et directement interprétable à partir du mécanisme réactionnel
Comme il est montré dans les pages "Ribonucléase A, mécanisme de la catalyse", les 2 résidus des histidines 12 et 19 de la protéine sont les acteurs de l'acte catalytique, l'hydrolyse d'un ARN. Quand on examine la catalyse, on peut voir que hist-12 doit être à l'état déprotoné (le doublet libre de l'azote va exercer une attaque nucléophile) et hist-119 doit être à l'état protoné (donneur de proton). Revoir les pages "Ribonucléase A, mécanisme de la catalyse". Ainsi l'aptitude à catalyser de la ribonucléase A va dépendre de l'état de protonation de his-12 et hist-119, état qui sera influencé par le pH ambiant.
Des études par RMN ont montré que les pKa des hist-12 et 119 sont respectivement les suivants lorsque le site actif est occupé :
pKa hist-12 site occupé = 7,8
pKa hist-119 site occupé = 7,2
On peut alors retrouver facilement l'effet du pH sur la constante catalytique, en zone d'effet réversible non dénaturant, en calculant pour différents pH la fraction déprotonée ou protonée de chacune des 2 histidines et en combinant les 2 résultats.
Comment calculer pour chaque pH la fraction déprotonée ou protonée de chaque histidine ?
Il suffit de résoudre le système pH = PK + log (B/A) et A + B = 1
où B désigne la fraction déprotonée et A la fraction protonée
Vous pouvez vérifier facilement que ce système a pour solution :
A = 1/(1+10pH-pK)
B = 1-[1/(1+10pH-pK)]
Comment calculer pour chaque pH l'aptitude catalytique potentielle de l'enzyme ?
En utilisant la résolution ci-dessus, on peut calculer pour chaque pH la fraction utile de hist-12, c'est à dire la fraction déprotonée de hist-12, c'est à dire B pour l'hist-12 (pK = 7,8). Soit Bhist-12 ces valeurs.
De même, on peut calculer pour chaque pH la fraction utile de hist-119, c'est à dire la fraction protonée de hist-119, c'est à dire A pour l'hist-119 (pK = 7,2). Soit Ahist-119 ces valeurs.
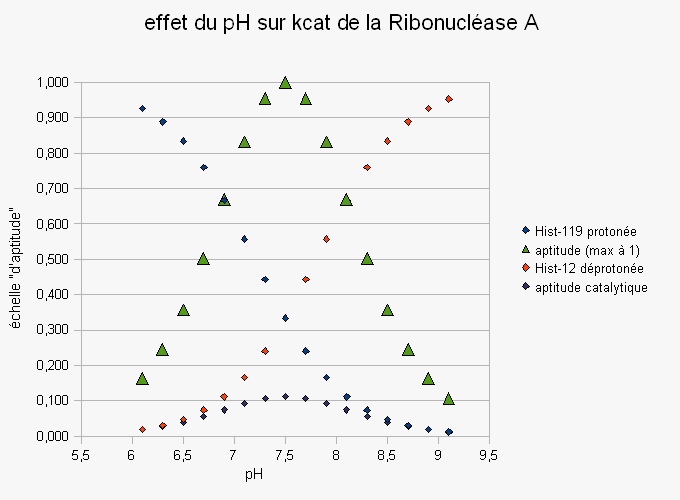
Le produit Bhist-12 * Ahist-119 donnera pour chaque pH, le potentiel d'aptitude catalytique de l'enzyme.
Comment visualiser tout ça ?
Avec un beau graphique ...
Voici un lien vers une feuille "tableur" qui automatise les calculs ... et présente les graphes obtenus (Tableur LibreOffice)
Voici un tableau des résultats des calculs puis les graphes obtenus :
pH |
Ahist-119 |
Bhist-12 |
aptitude catalytique |
aptitude catalytique max. à 1 |
| 6.1 | 0.926 | 0.020 | 0.018 | 0.16 |
| 6.3 | 0.888 | 0.031 | 0.027 | 0.24 |
| 6.5 | 0.834 | 0.048 | 0.040 | 0.36 |
| 6.7 | 0.760 | 0.074 | 0.056 | 0.5 |
| 6.9 | 0.666 | 0.112 | 0.074 | 0.67 |
| 7.1 | 0.557 | 0.166 | 0.093 | 0.83 |
| 7.3 | 0.443 | 0.240 | 0.106 | 0.95 |
| 7.5 | 0.334 | 0.334 | 0.111 | 1 |
| 7.7 | 0.240 | 0.443 | 0.106 | 0.95 |
| 7.9 | 0.166 | 0.557 | 0.093 | 0.83 |
| 8.1 | 0.112 | 0.666 | 0.074 | 0.67 |
| 8.3 | 0.074 | 0.760 | 0.056 | 0.50 |
| 8.5 | 0.048 | 0.834 | 0.040 | 0.36 |
| 8.7 | 0.031 | 0.888 | 0.027 | 0.24 |
| 8.9 | 0.020 | 0.926 | 0.018 | 0.16 |
| 9.1 | 0.012 | 0.952 | 0.012 | 0.11 |
Bibliographie = Jean Pelmont, Enzymes, 1989, PUG
Note importante. Historiquement, ce sont les études k0 = f(pH) qui ont été premières et une dialectique subtile entre différentes techniques et différentes théories et publications a peu à peu éclairci et clairement connecté mécanisme réactionnel, structure de siite actif et effet pH. Les propos ci-dessus sont an-historiques.