Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour octobre 2016
[A propos de l'auteur]
[Droits de copie]
On suppose qu'on travaille dans la zone d'effets réversibles du pH (on peut dire aussi zone de stabilité au pH).
A la lumière des deux exemples vus précédemment, on voit que le pH agit en modifiant l'état de protonation de résidus aminoacyls proposant des couples acide/base et qui sont des résidus clés, limitants, pour l'acte catalytique et/ou la liaison du substrat et/ou la géométrie du site actif. Les effets se font donc ressentir sur les paramètres cinétiques k0 et/ou Km et k0/Km. Ces résidus clés limitants doivent être, selon les enzymes, soit à l'état protoné soit à l'état déprotoné pour pour l'acte catalytique et/ou la liaison du substrat et/ou la géométrie du site actif.On peut donc construire le tableau simple suivant :
Résidu(s) déterminant(s) pour l'acte catalytique |
Résidu(s) déterminant(s) pour l'affinité apparente pour le substrat |
|||
Doit être protoné |
Doit être déprotoné |
Doit être protoné |
Doit être déprotoné |
|
k0 diminue quand pH augmente
|
k0 diminue quand pH diminue
|
Km augmente (moins d'affinité) quand pH augmente
|
Km augmente (moins d'affinité) quand pH diminue
|
|
Effet de cloche quand les 2 cas cohabitent. |
Effet de bol quand les 2 cas cohabitent.
|
|||
Il peut y avoir des cas d'indépendance au pH dans la zone de réversibilité, la papaine est le cas le plus cité dans les cours en lignes et les ouvrages pour étudiants. Dans la littérature que j'ai pu consulter, c'est vrai mais uniquement pour le paramètre Km, indépendant du pH sur la zone de pH 3,7-9,3
L'efficacité combine, pour [S] <<<Km les effets sur k0 et Km. La meilleure efficacité implique un "gros k0 et un petit Km". Les allures générales sont en cloche. Sauf quand elles ne le sont pas ...
On rappelle qu'à concentration en substrat très petite devant le Km, la relation de Michaelis \( v_i = k_0 [E_0] \frac {[S]}{K_m + [S]} \) devient quasi assimilable à \( v_i = \frac {k_0}{K_m} [E_0][S]] \).
Deux exemples classiques sous forme de figures ci-dessous.
k0/Km, exemple d'allure en cloche par seul effet sur k0 |
k0/Km, exemple d'allure en cloche par combinaison d'effets sur k0 et Km |
D'après l'article Le Km est indépendant du pH entre 3,7 et 9,3, la cloche est due au seul effet sur k0. 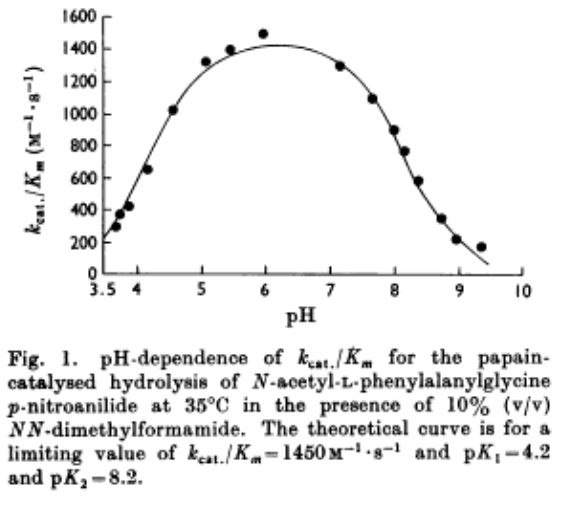 |
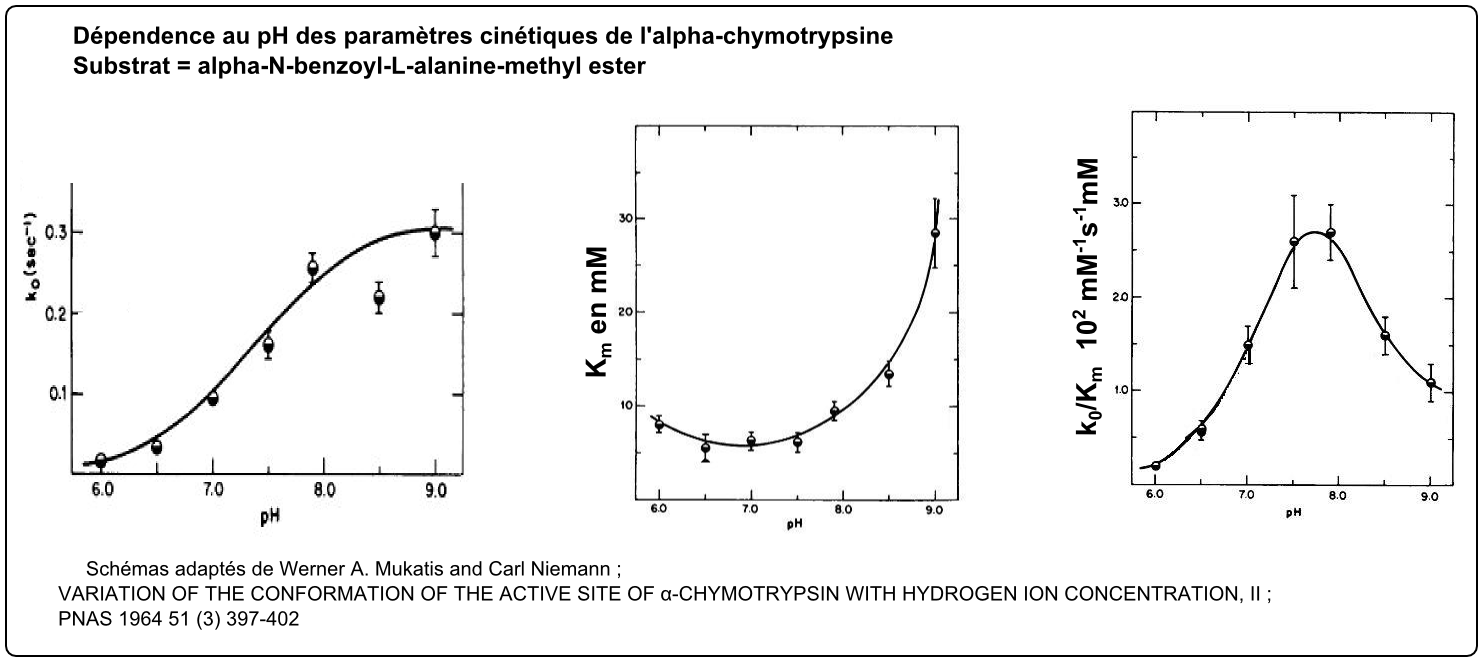 |
Et un exemple moins classique ci-dessous, pas d'allure en cloche.
k0/Km, exemple d'allure à 1 seule limitation par le pH (bacteriophage K1 endosialidase  |
(Morley, Thomas J. et al. "A New Sialidase Mechanism: BACTERIOPHAGE K1F ENDO-SIALIDASE IS AN INVERTING GLYCOSIDASE." The Journal of Biological Chemistry 284.26 (2009): 17404-17410). |
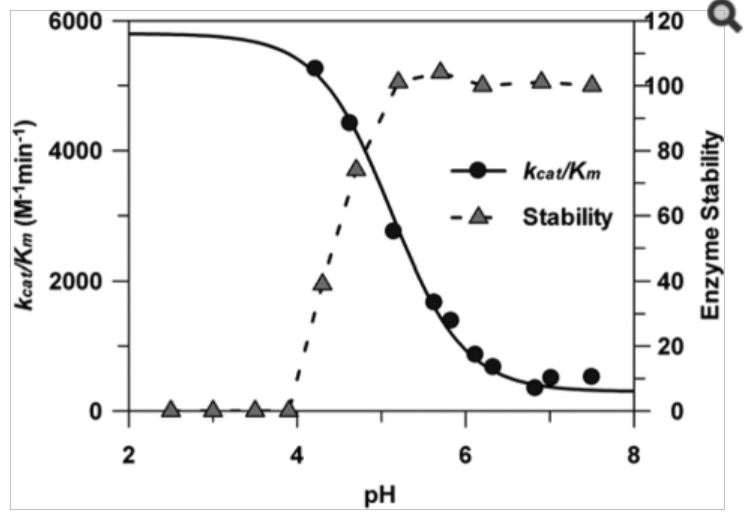 |
Attention, les pK des résidus amminoacyls présentant des fonctions acide/base peuvent être très différents des valeurs usuelles en solutions aqueuse du fait des environnement très spéciaux qui règnent dans les sites actifs !
Ainsi le noyau imidazol de l'histidine qui a un pK dans l'eau vers 4 est trouvé à pK depuis 6 à 8,5 dans les enzymes. Les fonctions carboxyliques en γ et β des résidus glutamate et aspartate de pK vers 4 dans l'eau peuvent avoir des pK entre 7 et 1 dans des sites actifs. Le -SH de la cystéine peut exprimer une acidité conséquente dans certains sites ...
Les modèles à 2 limitants sont du type "maillon faible", on s'intéresse en fait à chaque extrémité de pH, au premier "qui casse". On peut évidemment se livrer à des modélisations plus ou moins complexes intégrant les pK de plus de 2 résidus dont certains de pK très proches dont l'état de protonation importe...
Pour ceux qui adorent les calculs, un lien hommage vers un scan pdf de quelques pages du "polycopié de l'Université Paris VII, "Enzymologie, Cinétique", Licence de Biochimie, de Burstein, Chambert, Gonzy-Treboul, Guion-Rain, Orsini et Reboud, édition année universitaire 1980-1981 (publié pour le public étudiant de l'époque). Détermination des pKa de résidus aminoacyls déterminants pour k0 et Km à l'aide de l'étude expérimentale des paramètres cinétiques en fonction du pH.