Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour octobre 2016
[A propos de l'auteur]
[Droits de copie]
L'α-chymotrypsine , endopeptidase digestive, catalyse en conditions physiologiques l'hydrolyse de liaisons peptidiques en aval d'un résidu de tyrosine, de tryptophane, de phénylalanine ou de leucine. Elle peut hydrolyser des substrats synthétiques de type benzoyl-esters ou autres in vitro.
Voici des images extraites du plus ancien article (1964) sur les relations paramètres cinétiques de l'α-chymotrypsine pH que j'ai pu trouver :
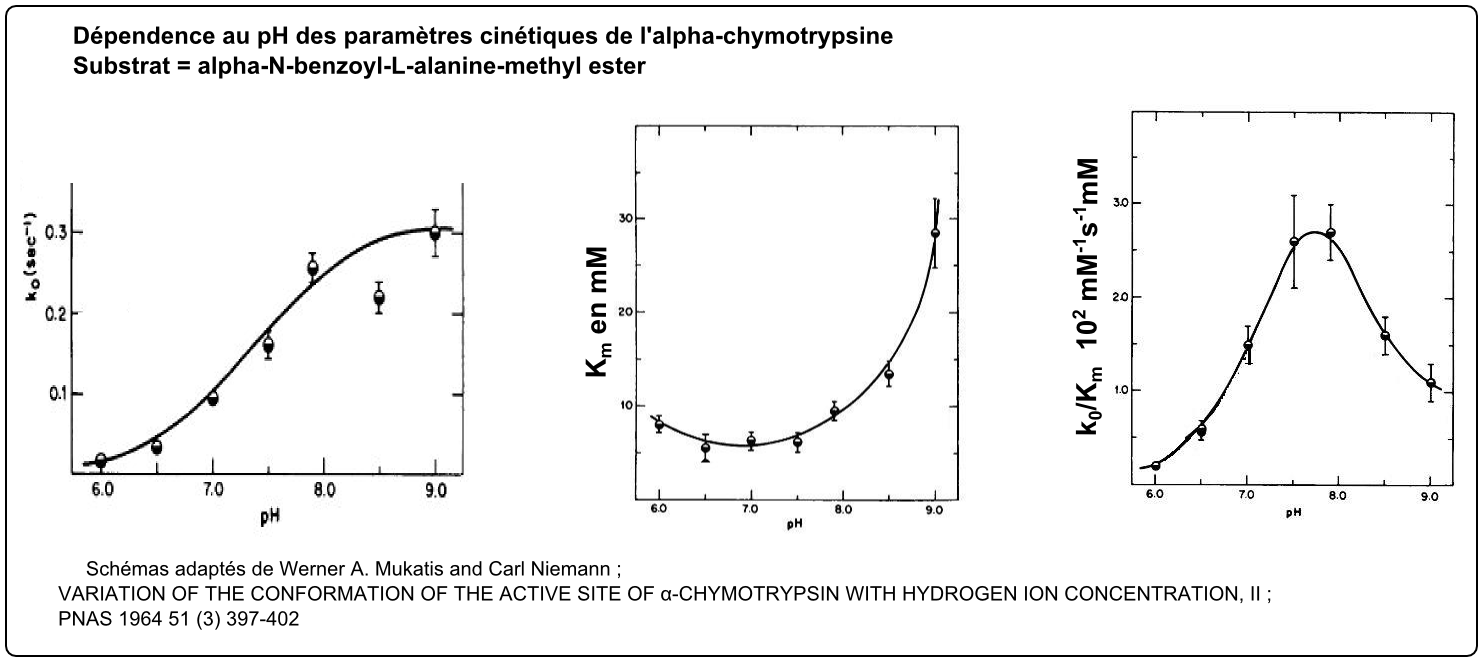
• Si on observe k0=f(pH) sur la zone testée, on peut voir une augmentation avec le pH. D'où l'hypothèse d'un résidu aminoacyl à couple acide/base qui doit être à l'état déprotoné pour l'aptitude à la catalyse. L'histoire a montré qu'il s'agissait du résidu histidinyl du site actif qui doit être déprotoné. L'α-chymotrypsine est une enzyme qui hydrolyse grâce à la présence conjuguée au site actif de la triade aspartate/histidine/sérine qui permet l'arrachage de H du -OH de la sérine et lui donne son caractère nucléophile puissant (un doublet d'électrons de la sérine va attaquer la liaison peptidique ou ester à hydrolyser). La sérine prend un caractère nucléophile au site actif grâce à l'histidine à l'état déprotoné et déstabilisée par l'aspartate 102. Comme indiqué dans la figure ci-dessous.
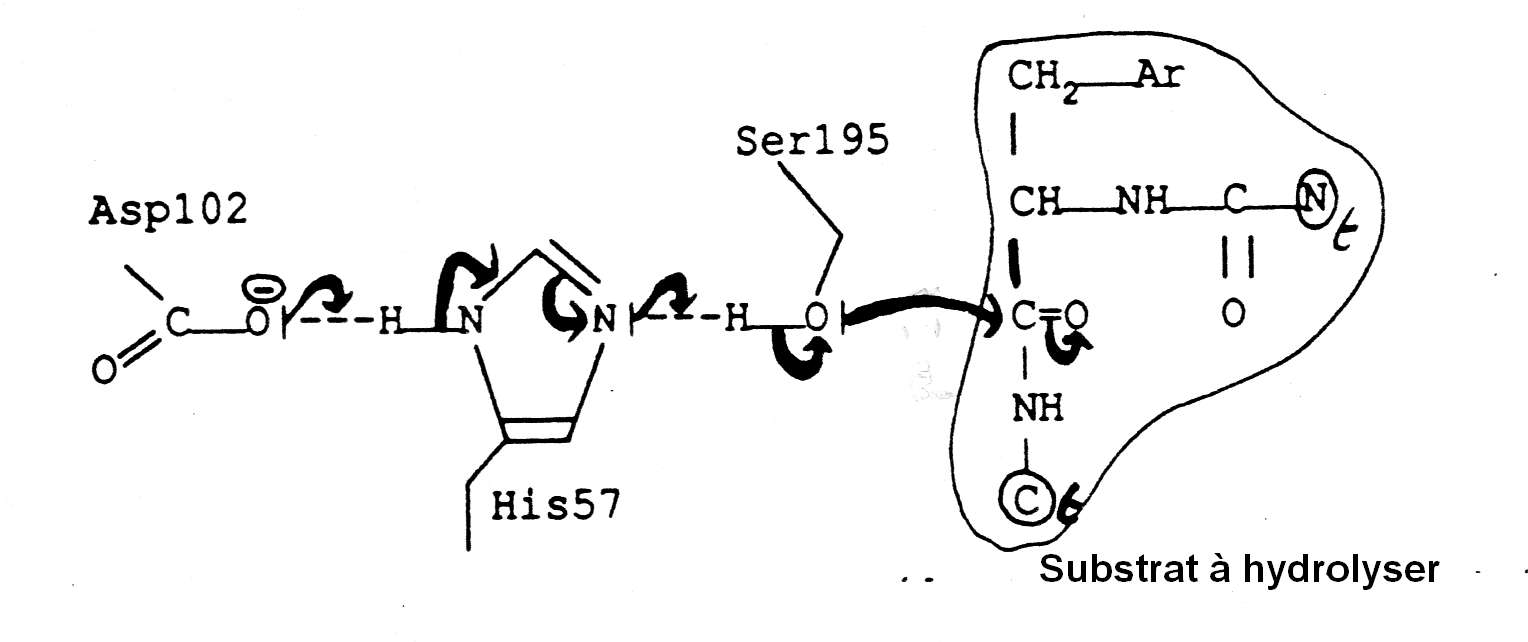
Note. Wikipedia donne un bon schéma du mécanisme catalytique complet :https://fr.wikipedia.org/wiki/Chymotrypsine.
• Si on observe Km=f(pH) sur la zone testée, on constate que plus le pH est acide plus Km est faible donc plus l'affinité apparente pour le substrat est améliorée (un bon Km est un petit Km...). On a pu montrer qu'il s'agissait essentiellement d'un effet sur la protonation de l'N terminal de la chymotrypsine (Ileu 16 N terminale) qui est engagé dans la formation même de la géométrie du site actif. Ileu 16, clé pour la fixation du substrat, doit être protonée-NH3+.
Pour ceux qui veulent en savoir plus. La chymotrypsine active est issue du clivage protéolytique activateur de son précurseur inactif zymogène appelé chymotrypsinogène. Un clivage essentiel entre l'arginine 15 et l'isoleucine 16 libère une extrémité N terminale leucine qui (à l'état protoné ), chargée +, déclenche un changement conformationnel qui "ouvre" le site actif . Image à http://www.cell.com/cms/attachment/614850/4948527/gr1.jpg.
• A concentration en substrat très petite devant le Km, la relation de Michaelis \( v_i = k_0 [E_0] \frac {[S]}{K_m + [S]} \) devient quasi assimilable à \( v_i = \frac {k_0}{K_m} [E_0][S]] \). k0/Km est appelé efficacité et la courbe en cloche pour la fonction k0/Km = f(pH) montre le bilan des 2 effets contradictoires du pH sur l'efficacité de l'enzyme. L'amélioration d'efficacité entre pH 6 et 8 est due à l'amélioration de k0 (nombre de rotations catalytiques) entre 6 et 8 : l'histidine du centre catalytique doit être déprotonée ce qui est favorisé en passant de pH 6 à 8. La diminution d'efficacité au delà de pH 8 est due à la déterioration du Km au delà de ce pH : les pH alacalins favorisent la déprotonation de Ileu16 (perte de charge +) et une perte de conformation correcte du site actif et donc une baisse d'affinité qui se traduit par une forte augmentation de Km.