Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2012
[A propos de l'auteur]
[Droits de copie]
On a vu dans les paragraphes précédents que le mécanisme ordonné ping-pong conduit à une équation de vitesse initiale remarquable (l'effet parallélisme en représentation en double inverse)qui le différencie des 2 mécanismes à complexe ternaire, l'ordonné et l'aléatoire. Ces 2 derniers mécanismmes ne pouvant être différenciés.
L'étude des inhibitions par ajout des produits P ou Q dans le milieu réactionnel permet en général de différencier les mécanismes à complexe ternaire ordonné ou aléatoire. Les démonstrations ne sont pas simple et ce paragraphe se contentera de présenter quelques règles et quelques applications.
Dans la suite, concernant les effets d'inhibition par les produits P et Q, on utilisera la nomenclature IUBMB suivante :
• Km augmenté, k0 non modifié = inhibition compétitive ;
• diminution de Km et k0 mais dans les mêmes proportions (rapport inchangé) = inhibition incompétitive (uncompetitive) ;
• autres cas = inhibition mixte (Km modifié, k0 diminué) ;
Note : pour les "puristes" de la nomenclature des effets d'inhibitions réversibles, l'inhibition dite non compétitive pure est un cas d'inhibition mixte ou seul k0 est abaissé ( Km inchangé).
Ces règles résument des résultats obtenus à la suite du traitement mathématique formel des cinétiques enzymatiques bi bi par la méthode de King-Altman...
Règle n°1 : un produit qui se fixe sur la même forme enzymatique qu'un substrat se comporte comme un inhibiteur compétitif (C) de ce substrat
Règle n°2 : un produit qui ne se fixe que sur une autre forme enzymatique que celle qui fixe un substrat se comporte comme un inhibiteur : Mixte (M) si toutes les réactions qui existent entre les deux formes enzymatiques sont réversibles. Incompétitif (ou conditionnel), lorsque le produit et le substrat considéré se lient à des formes différentes de l'enzyme et séparées par une étape irréversible.
Règle n°3 : Une suite de réactions théoriquement réversible sera en fait irréversible si elle est d'un des 2 types : présence d'une concentration saturante du 2° substrat qui se fixe après le 1° substrat qui est considéré. présence d'une concentration nulle du 1° produit qui se libère avant le 2° produit qui est considéré.
(Le mécanisme bi bi ping-pong n'est pas traité par le tableau puisque sa détermination est possible par la seule étude des fonctions vi=f([A] à B paramétrique) ou vi=f([B] à A paramétrique).
On appelle A et B les substrats, P et Q les produits. les possibilités de fixation des substrats : aléatoire(aléa); si fixation ordonnnée par convention A se fixe avant B (A/B). Les possibilités de libération des produits : aléatoire (aléa); si libération ordonnée par convention P se libère avant Q (P/Q). On réalise des milieux réactionnels avec A et B, l'enzyme et on rajoute un seul des produits dans le milieu (soit P soit Q) comme inhibiteur. Et on mesure la vitesse initiale de catalyse (disparition de A ou de B par exemple). Les règles de Cleland permettent de prévoir les effets de cette addition sur les diagrammes de LB selon le tableau suivant.
Ordre des substrats | Ordre des produits | Produit ajouté au milieu réactionnel |
Effet inhibiteur | Effet inhibiteur |
aléatoire | aléatoire | P |
Compétitif (C) | C |
Q | C | C |
||
P/Q | P |
Mixte (M) | M |
|
Q | C | C |
||
A/B | aléatoire | P |
C | M |
Q | C | M |
||
P/Q | P |
M | M |
|
Q | C | M |
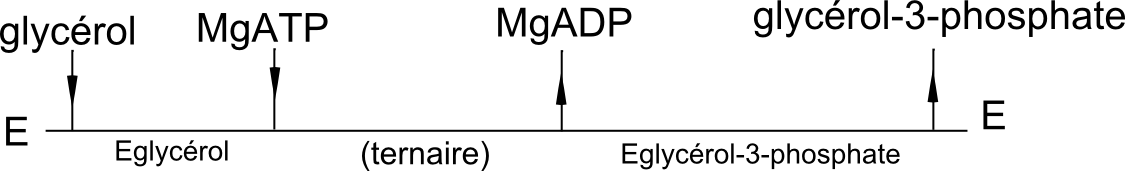
Les glycérol kinases (ATP:glycérol 3-phosphotransferase, EC 2.7.1.30) catalysent la réaction bi-bi (2 substrats, 2 produits) suivante :
MgATP + glycérol = MgADP + glycérol-3-phosphate (réaction équilibrée)
Dans le sens MgATP + glycérol -> MgADP + glycérol-3-phosphate |
Dans le sens MgADP + glycérol-3-phosphate -> MgATP + glycérol |
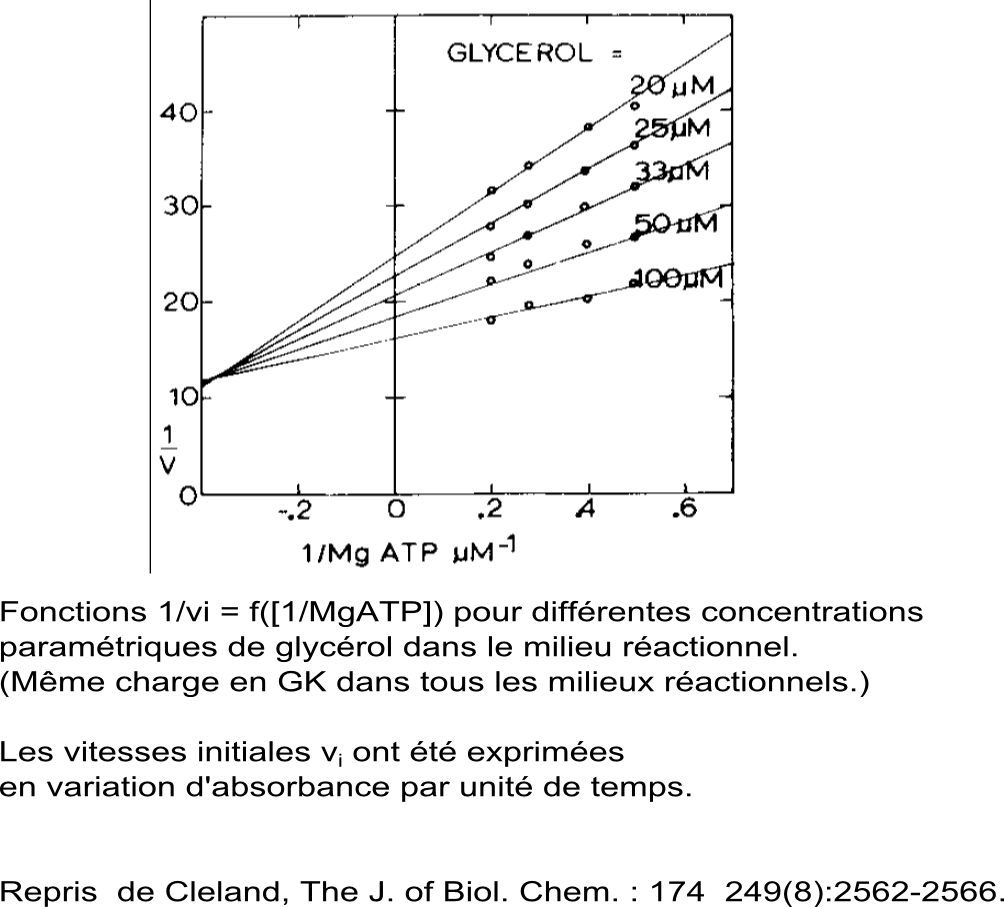
Mesures de vitesse initiale en continu dans le milieu réactionnel standardisé par absortiométrie à 340 nm grâce au couplage avecune réaction auxiliaire catalysée par la pyruvate kinase (PK) et une réaction indicatrice catalysée par la lactate déshydrogénase (LDH). |
Mesures de vitesse initiale en continu dans le milieu réactionnel standardisé par absortiométrie à 340 nm grâce au couplage avecune réaction auxiliaire catalysée par l'hexokinase (HK) et une réaction indicatrice catalysée par la glucose-6-phosphate déshydrogénase (G6PDH). |
 |
|
Conclusion : Les allures obtenues invalident un mécanisme ping-pong et plaident en faveur d'un mécanisme à complexe ternaire, ordonné ou aléatoire pour la fixation et/ou la libération des substrats et produits. |
|
L'étude des inhibitions par les produits de réactions va permettre de proposer un mécanisme réactionnel :
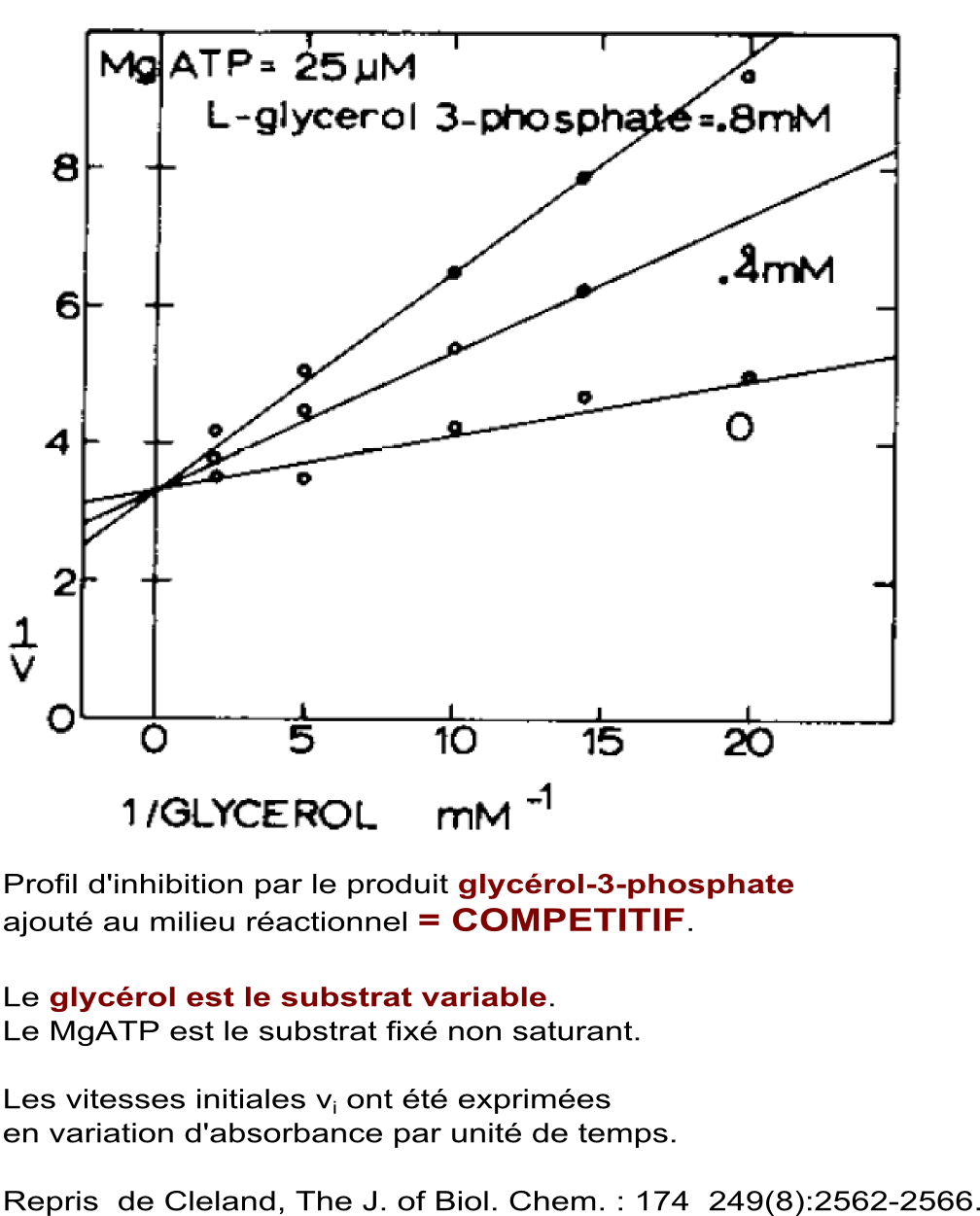
Etude d'effets inhibiteurs par les produits ajoutés au milieu réactionnel dans le sens MgATP + glycérol -> MgADP + glycérol-3-phosphate |
|
 |
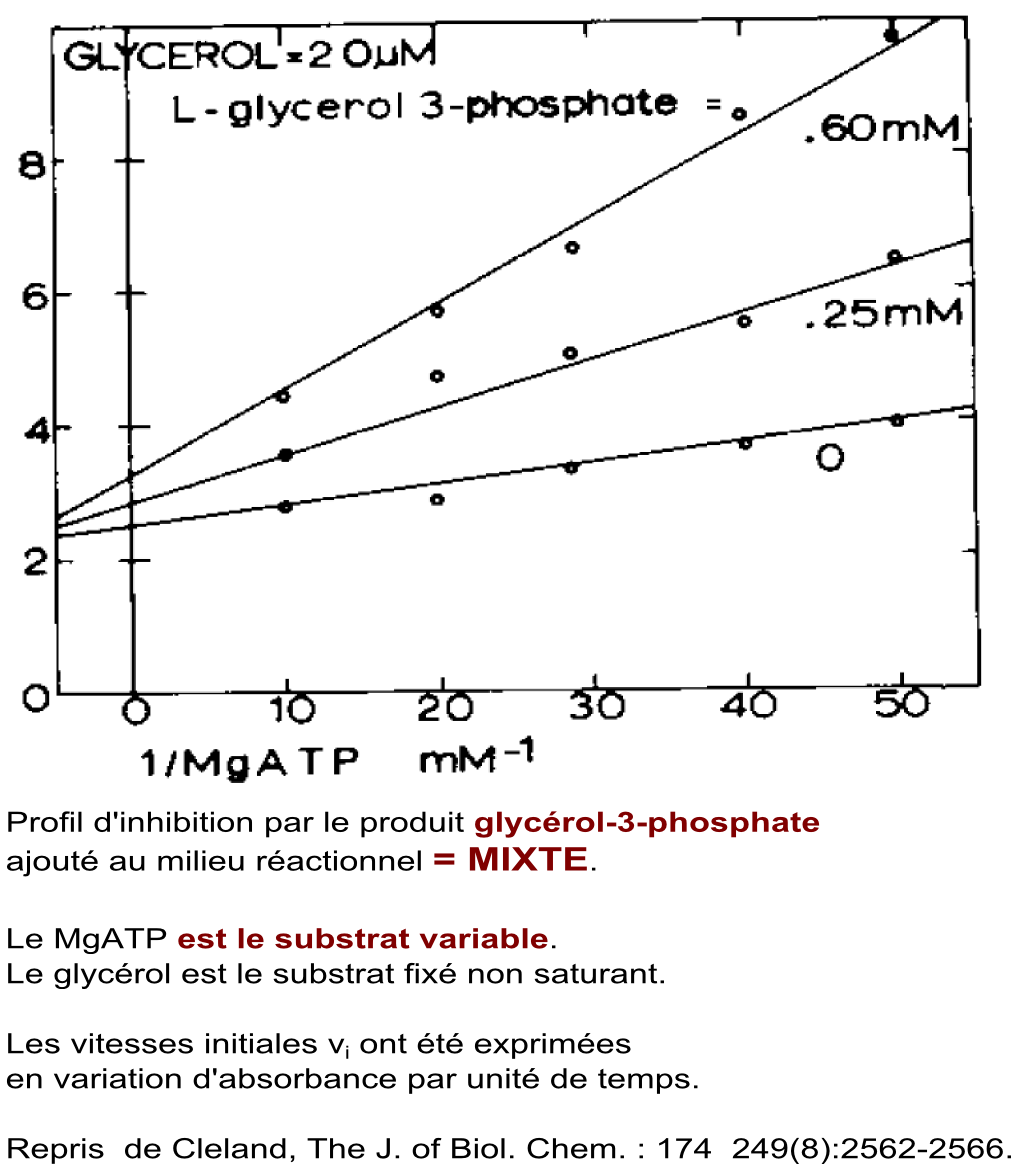 |
Conclusion : Les types d'inhibitions obtenues orientent vers un mécanisme à fixation ordonnée des substrats : premier substrat fixé = glycérol, deuxième substrat fixé = MgATP. Conclusion établie en consultant le tableau d'inhibitions par les produits présentés ci-dessus. |
|
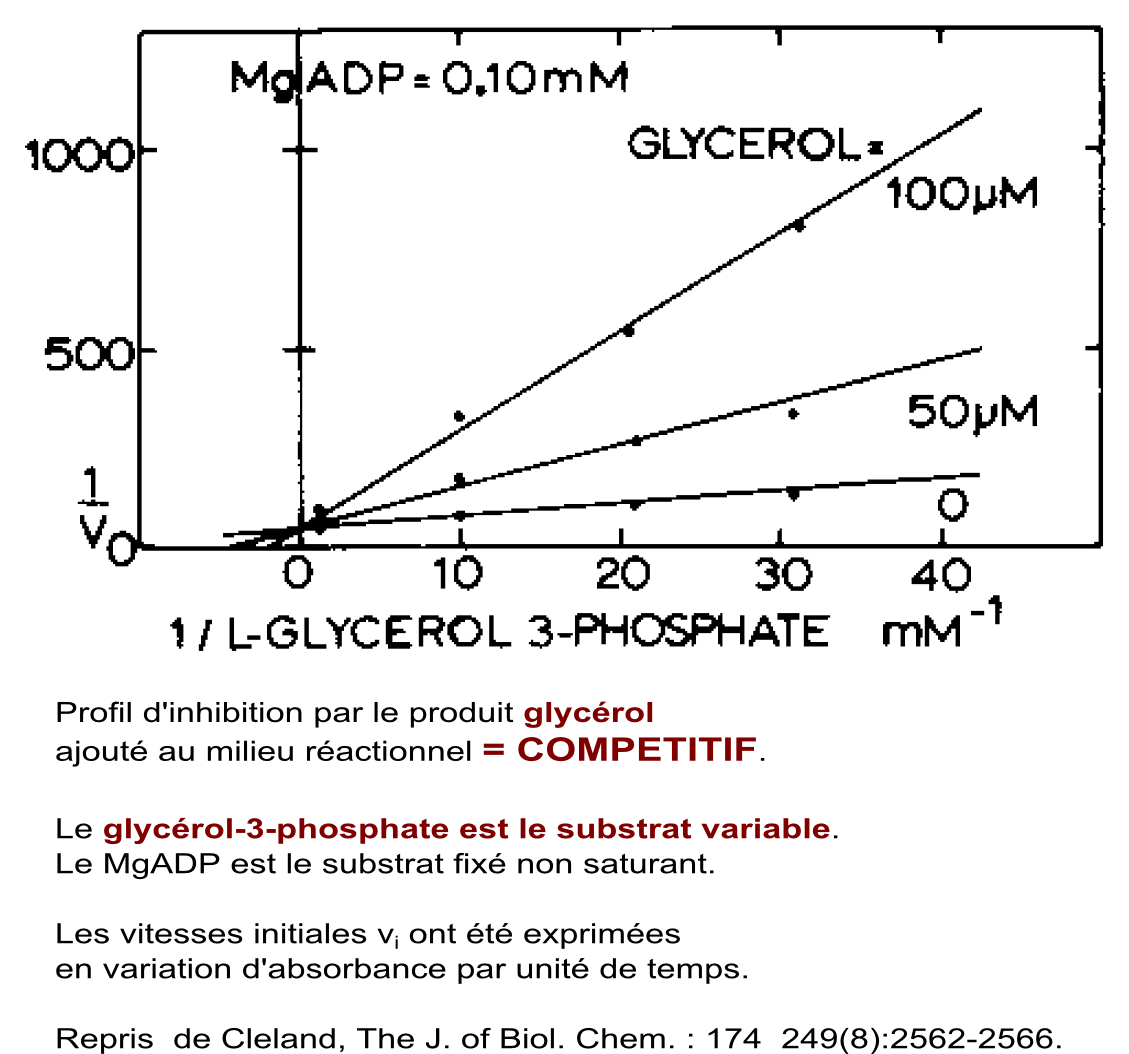
Etude d'effets inhibiteurs par les produits ajoutés au milieu réactionnel dans le sens MgADP + glycérol-3-phosphate -> MgATP + glycérol
|
|
 |
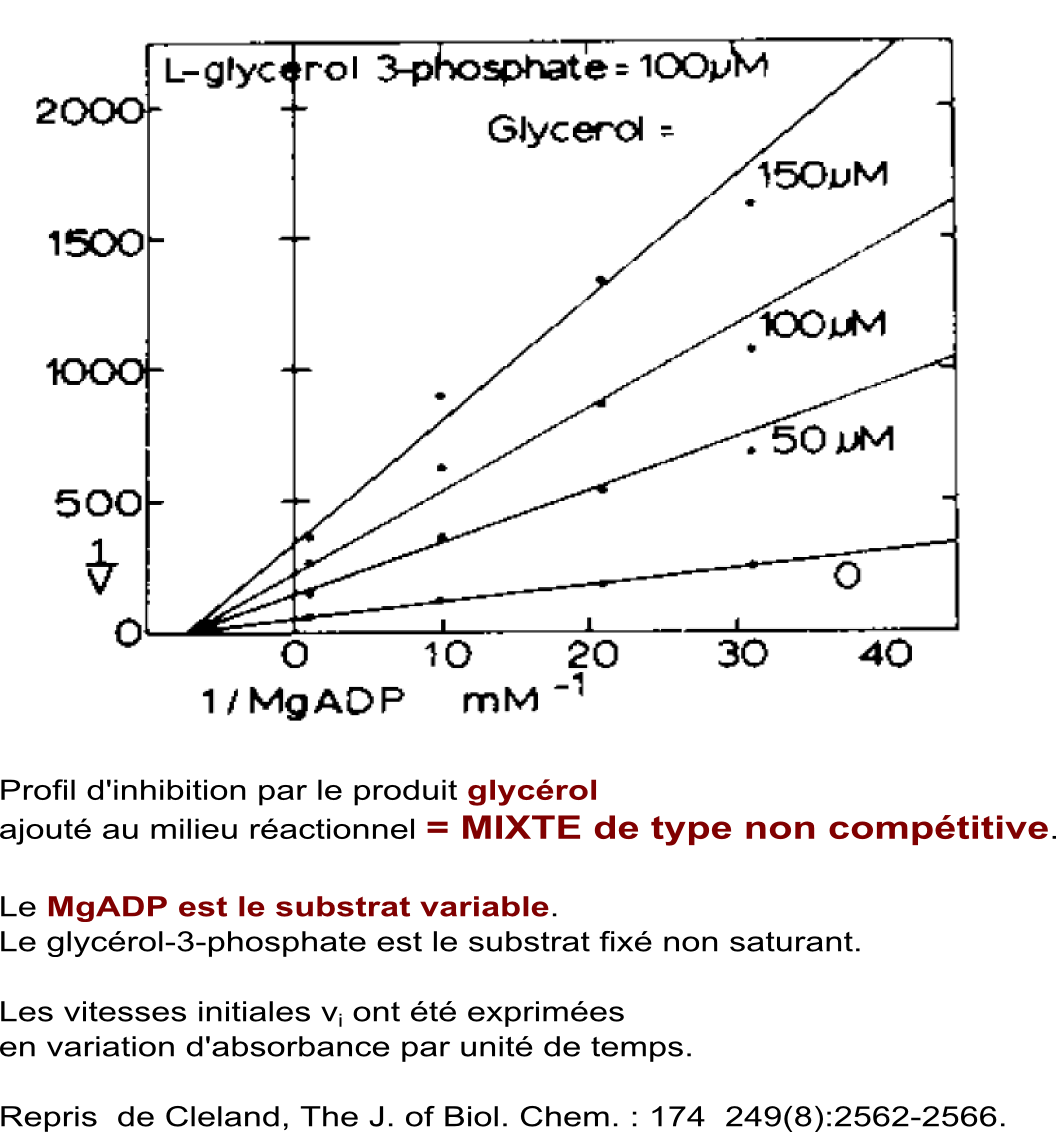 |
Conclusion : Les types d'inhibitions obtenues orientent vers un mécanisme à fixation ordonnée des substrats : premier substrat fixé = glycérol-3-phosphate, deuxième substrat fixé = MgADP. Conclusion établie en consultant le tableau d'inhibitions par les produits présentés ci-dessus. |
|
En combinant l'ensemble des résulats obtenus, on peut proposer la mécanique ordonnée à complexe ternaire suivante :