Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2012
[A propos de l'auteur]
[Droits de copie]
Si les réactions à 2 substrats sont les plus fréquentes en enzymologie, on peut trouver des réactions à 3 substrats. La mécanique réactionnelle peut ainsi devenir très complexe.
Un unique exemple sera présenté ici, le cas de la glutathion oxydase (sulfhydryl oxydase) (du lait de vache). La réaction catalysée est la suivante
(avec le substrat glutathion symbolisé par GSH car intéressant par sa fonction thiol -SH) :
O2 + GSH + GSH = H2O2 + GSSG
On a ainsi une réaction à 3 substrats et 2 produits (ter bi).
La mécanique réactionnelle comme annocée dans Biochem J. 1984 May 15; 220(1): 5155 est celle présentée ci-dessous, où l'enzyme libre est représentée par ESH pour insister sur la cystéine du site actif et la formation d'un pont S-S en cours de catalyse entre cette cystéine et le substrat GSH (donc un intermédiaire réactionnel covalent).
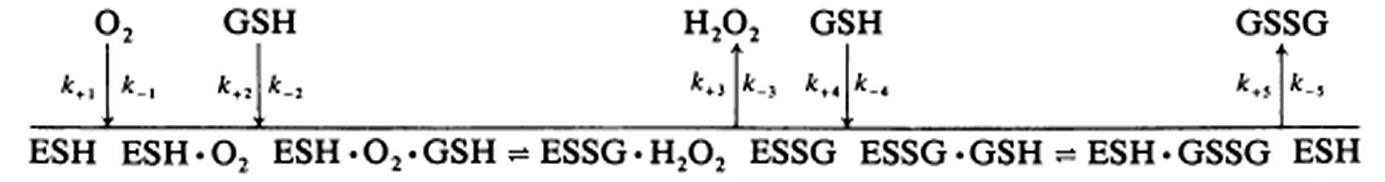
Comment qualifier ce mécanisme ? Par exemple de mécanisme ping-pong bi uni uni uni uni en prenant comme appellation de référence pour le ping-pong bi bi de base l'appellation ping-pong uni uni uni uni ! On peut évidemment oublier les affaires de bi et autres uni, mais il est intéressant de remarquer le caractère ping-pong de la réaction assez évident une fois qu'on a lié O2 et le premier GSH au site actif.
Sliwkowski, Swaisgood, Clare et Horton fournissent même l'équation globale de cinétique de la réaction catalysée par l'enzyme à l'état stationnaire (vitesse initiale, pas de produits de réaction dans le milieu réactionnel) dans Biochem J. 1984 May 15; 220(1): 5155 :
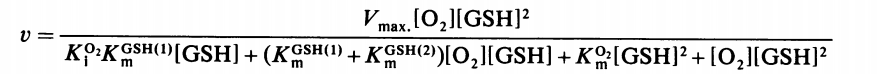
L'allure sera Michaélienne avec O2 substrat variable et GSH paramétrique mais plus vraiment avec GSH variable. En effet, on a du [GSH]2 !