Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour mars 2015
[A propos de l'auteur]
[Droits de copie]
De nombreux procédés mécaniques permettent de lyser différents types cellulaires afin d'obtenir des extraits appelés classiquement extraits protéines totales hydrosolubles. Selon les types de parois cellulaires rencontrées (ou leur absence), la libération des protéines totales hydrosolubles sera plus ou moins difficille à obtenir.
L'objectif est de cisailler les cellules pour les "exploser". Plus facile à faire évidemment avec des cellules animales qu'avec des cellules de levures ou de plantes !
On trouve de multiples matériels dont voici quelques exemples :
- Manuel. broyage au mortier et pilon en présence de sable. Très simple. S'utilise par exemple pour la lyse de levures ou de tissus végétaux. Souvent associé avec un échantillon congelé (-80°C, diazote liquide). Réservé aux petis échantillons évidemment ... ;
- Avec motorisation. Systèmes motorisés à mortier/pilon, appareils à rotor/stator générant d'importants effets de cisaillements, systèmes rotatifs avec projections de billes... Et les homogénéiseurs dits Potter (un piston en rotation est mis en va et vient
à l'intérieur d'un tube au diamètre très ajusté, les fragments de tissu à lyser sont "éclatés" lors du passage entre le piston et la paroi du tube, réservé aux tissus mous, aux cellules animales sans paroi).
Un cycle ou des cycles de congélation/décongélation sont parfois associés : il s'agit d'obtenir une série d'effets de cristallisation/fusion de l'eau qui va participer à la destruction des édifices de paroi et de membranes.
Dans la Presse dite de French et ses différentes évolutions (homogénéisateurs sous pression à valve), l'effet de cisaillement et de cavitation qui conduit à la lyse cellulaire et à l'homogénéisation est produit en mettant l'échantillon sous très haute pression (souvent plus de 1500 bars) et en le forçant à travers un orifice très fin et contre une valve dite valve d'homogénéisation. La température et les moussages doivent être sérieusement contrôlés.
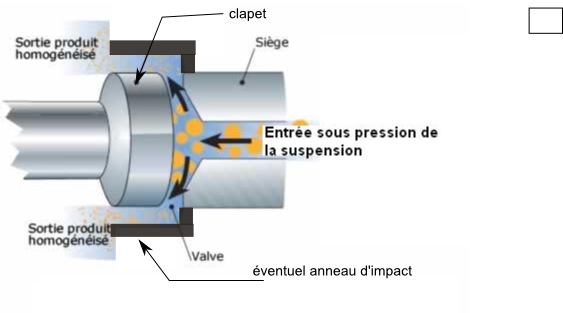
Ci-dessus schéma de valve d'homogénéisation. Schéma adapté de http://www.azaquar.com/doc/technologie-des-laits-de-consommation-lait-pasteuris%C3%A9-st%C3%A9rilis%C3%A9-et-uht (consult. 02/2015)
Dans cette catégorie d'homogénéisateurs, signalons la "bombe à disruption". L'échantillon placé sous très forte pression de diazote est soudainement dépressurisé.
Le diazote fortement solubilisé sous très haute pression
va dégazer sous formes de bulles en expansion qui vont étirer les membranes jusqu'à rupture et donc lyse cellulaire.
La sonde du sonicateur va mettre le milieu en vibration ultrasonique (fréquence de 20 ou 40 kHz classiquement). Les ondes de pression des vibrations vont déclencher un phénomène de "cavitation". Des microbulles d'eau à l'état gazeux vont se former, grandir subitement puis imploser. L'implosion est accompagnée d'une très haute et très brève augmentation locale de la pression et de la température : pression locale de plusieurs centaines d'atmosphère et température locale de 4000 à 5000°C. De quoi pulvériser localement les cellules. Les conditions opératoires de fréquence de la sonde, de puissance délivrée, de nombre et de durée phases de sonication et de contrôle de température devront permettre la lyse cellulaire tout en respectant l'intégrité de la protéine à purifier (pas toujours évident).
Méthode normalement réservée aux petits volumes à l'échelle du laboratoire, même si on voit apparaître des "sonicateurs en continu".
L'emploi de détergents convenablement dosés permet de désorganiser les édifices membranaires en double feuillet phospholipidiques tout en préservant les conformations protéiques natives. Un détergent souvent utilisé dans les réactifs chimiques de lyse est le tritonX-100. L'usage de tampons avec détergents et une homogénéisation mécanique pas très puissante peuvent suffire pour lyser des cellules sans paroi comme des cellules d'insecte...
Des enzymes permettent de lyser les parois. Le lysozyme est utilisé pour digérer le peptidoglycane des parois des bactéries. Le peptidoglycane est normalement directement accessible au lysozyme chez les bactéries gram+ mais ne l'est pas chez les gram- du fait de la présence de la membrane externe. Le traitement des gram- impose de perméabiliser la membrane externe au lysozyme, ceci est généralement réalisé en tampon tris+EDTA : l'EDTA complexe les cations magnésium qui stabilisent le double feuillet membrane externe à lipopolysaccharide (particulièrement fragile), le tris est réputé être un agent perméabilisant des membranes externes. Des préparations enzymatiques de lyticase (une endo-β1-3 glucanase hydrolysant les liaisons β1-3 des glucanes appelés laminarine des parois des levures ) et/ou de zymolaseR (mélange d'enzymes, endo-β1-3 glucanases, mannanases, protéases sécrétées par Arthrobacter luteus et hydrolysant les composants de paroi des levures) sont commercialisées pour la digestion des parois des levures utilisées en biotechnologies, levure de bière, Pichia...
Attention, les lyses chimiques simples libèrent de l'ADN assez intact qui rend les milieux très visqueux et potentiellement perturbateur des étapes ultérieures de purification ! Il faudra soit le casser mécaniquement, soit l'hydrolyser enzymatiquement afin de fluidiser l'extrait. On peut aussi précipiter sélectivement les acides nucléiques avec des précipitants de type polyethylèneimine, PEI, (polymère cationique) ou protamine sulfate, PS, (peptides cationiques). Le principe de cette précipitation est le suivant : le polymère cationique va lier l'acide nucléique par interactions électrostatique et l'ensemble polymère/acide nucléique va former un réseau précipitant. Des protéines particulièrement acides (chargées négativement) peuvent être entrainées lors de ce processus. Pour contrôler le phénomène on va jouer sur la force ionique (NaCl) : à force ionique très élevée, seuls les accides nucléiques, car ils proposent une densité de charge négative particulièrement élevée par leurs groupements aux phosphates, précipitent avec le PEI ou les PS. Tout ceci est mieux expliqué dans le chapitre "précipitations fractionnées" de cette section precipitation_3.php
Évidement il n'est pas interdit de combiner des moyens mécaniques et chimiques de lyse des cellules.
Il est possible de lyser des cellules sans paroi (en pratique des cellules animales) par choc osmotique. Les cellules sont placés dans un milieu hypotonique et l'entrée d'eau dans les cellules liée au gradient de pression osmotique entre le contenu cellulaire et le milieu externe va conduire à la lyse membranaire. On peut favoriser la lyse en déstabilisant chimiquement la membrane par un ajout en détergent et/ou en complexant des cations métalliques type EDTA.
Les bactéries gram- (didermes à membrane externe à Lipopolysaccharide) propose un espace périsplasmique entre la membrane plasmique et la membrane externe. Cet espace reçoit les des protéines sécrétées. Si la protéine d'intérêt à purifier est périplasmique, il est possible de libérer sélectivement les seules protéines périplasmiques. L'extrait obtenu ne contiendra pas le contenu cytoplamique, ce qui simplifiera beaucoup la purification ultérieure. Intéressant par exemple pour des protéines recombinées avec séquence signal de sécrétion dans l'espace périplasmique.
Le principe est le suivant : On fragilise sélectivement la membrane externe avec un complexant des cations métalliques type EDTA et on place les cellules en milieu hypertonique (par exemple en milieu hyper saccharosé). Un passage brutal en milieu hypotonique va entrainer la fuite spécifique de l'espace périplasmique alors que la membrane plasmique restera préservée.
Chez les eucaryotes, on peut fractionner les organites par centrifugations différentielles. Utilisable pour des purifications à l'échelle du laboratoire.
Voici un lien vers une figure très illustrative : http://www.ncbi.nlm.nih.gov/books/NBK21492/figure/A1135/?report=objectonly
Il s'agit d'une figure de la section Section 5.2 du chapitre "Purification of Cells and Their Parts" du manuel en ligne "Molecular Cell Biology. 4th edition" ; Lodish H, Berk A, Zipursky SL, et al.
New York: W. H. Freeman; 2000.
Pour purifier une protéine membranaire
Les paragraphes précédents s'adressaient à des protéines globulaires librement hydrosolubles. Concernant les protéines associées aux membranes, différents "types" rencontrés (voir aussi schéma ci-dessous) :
• les protéines membranaires intégrales (monotopiques ou polytopiques);
• les protéines membranaires périphériques à ancrage lipidique. ;
• les protéines membranaires périphériques en association électrostatique de surface avec la membrane et/ou en interactions avec des domaines globulaires hydrophiles de protéines intégrales.
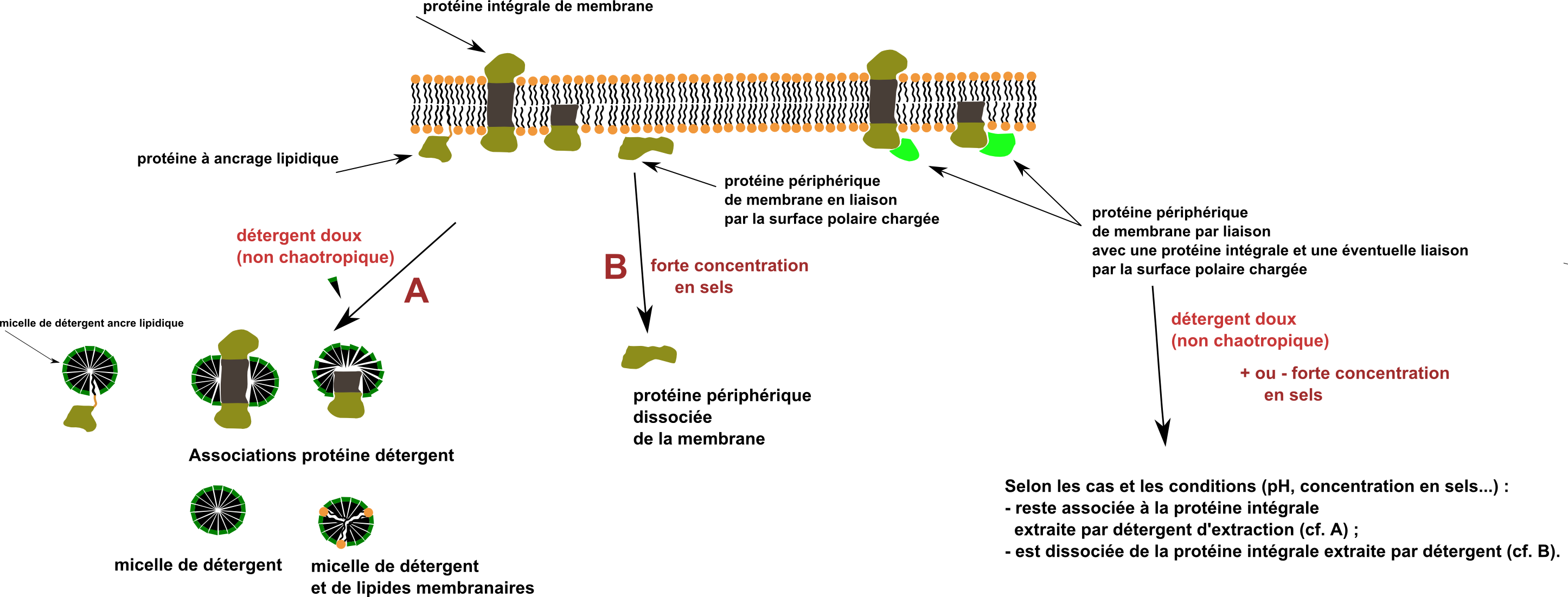
En général, pour isoler les protéines associées à la membrane, après lyse, on isole une fraction membranaire par centrifugation puis on traite avec le détergent où les détergents sélectionnés à la concentration qui se montre empiriquement efficace. On utilise des détergents non ioniques car les détergents ioniques sont chaotropiques (c'est à dire dénaturants. Un détergent ionique comme le SDS est dénaturant ; il suffit de penser SDS-page ...).
En fait, c'est un peu plus compliqué que ce que montre le schéma ci-dessus qui suppose un travail à une concentration en détergent supérieure à la concentration micellaire critique (CMC). Il est parfois possible de travailler en dessous de la CMC et d'extraire des protéines membranaires sous forme soluble non intégrée à une structure micellaire. On trouvera des données précises dans Lin, S.-H., & Guidotti, G. (2009). Chapter 35 Purification of Membrane Proteins. Guide to Protein Purification, 2nd Edition, 619–629 et aussi dans la documentation internet de la société commerciale Thermofisher https://www.thermofisher.com/order/catalog/product/89842 et dans Smith, S. M. (2010). Strategies for the Purification of Membrane Proteins. Protein Chromatography, 485–496.
Dans une cellule, pour les protéines en synthèse, il y a une compétition entre le repliement et l'agrégation. Dans beaucoup de cellules induites pour la production de protéines recombinées, une large fraction s'accumule en agrégats intracellulaires insolubles appelés corps d'inclusion. Dans les corps d'inclusion les protéines ne sont pas repliées et sont inactives. Cependant on peut voir un avantage à la présence de corps d'inclusions : les protéines recombinées sur-exprimées y sont presque déjà purifiées, elles y sont protégées des dégradations protéolytiques et elles y sont sous une forme qui protège l'hôte cellulaire des effets toxiques de la protéine recombinée et/ou de sa sur-expression.
Pour qui sait récupérer les corps d'inclusion et déclencher solubilisation et repliement vers les formes natives, il y a là une bonne stratégie de purification.
Une étape de lyse cellulaire complète (qui associe en général moyens chimiques et mécaniques) permet d'isoler les corps d'inclusion par centrifugation et "lavage" en présence de détergents doux et de faibles concentrations en agents chaotropiques type urée ou chlorure de guanidinium (pour solubiliser les contaminants membranaires et dissocier des associations éventuelles corps d'inclusions autres protéines).
Les corps d'inclusion isolés et lavés sont alors traités en milieu chaotropique fort (urée ou chlorure de guanidinium concentré) et réducteur (DTT ou 2-mercaptoéthanol). Les protéines dénaturées sont ainsi solubilisées. (Note : Les protéines dénaturées solubilisées peuvent même parfois être purifiées par chromatographie en conditions dénaturantes si elles possèdent une étiquette comme l'étiquette polyhistidine.)
Puis il faut renaturer. La renaturation est un processus complexe qui exige de faibles concentrations en protéines et dont les modes opératoires sont très empiriques et au cas par cas. Il s'agit d'éliminer en douceur les agents chaotropiques et réducteurs pour que la renaturation puisse se produire. On le réalise par dialyse ou par dilutions successives ou par modification des conditions de milieu avec des protéines dénaturées "fixées" sur support chromatographique.