Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2010-2022
[A propos de l'auteur]
[Droits de copie]
La plupart des réactions enzymatiques sont des réactions bi-bi (2 substrats, 2 produits). Une réaction catalysée par une enzyme E peut ainsi s'écrire :
S + T <---------> P + Q
où S, T, P, Q désignent les espèces
chimiques de la réaction.
On réalise une série d'expériences de cinétiques selon les conditions opératoires décrites ci-après.
On admet que l'on dispose d'une préparation enzymatique qui se conserve parfaitement pendant toute l'expérience. [S]0 , [T]0 , [P]0 et [Q]0 désignent respectivement les concentrations initiales en S, T, P et Q dans le milieu réactionnel. [E0]désigne la concentration totale en enzyme E dans le milieu réactionnel.
 |
À t = 0, on introduit un volume x de préparation enzymatique. On homogénéise très rapidement. On suit alors la réaction par [S]=f(t) ou [P]=f(t). |
|
Milieu réactionnel (MR): On suit la diminution de S
ou l'apparition de P. |
Et voilà le type de suivi qu'on obtient pour [P]=f(t):
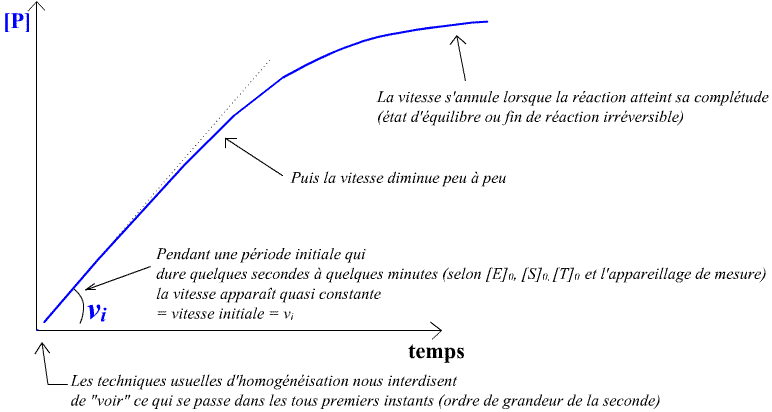
Avec, évidemment le pendant exact - en diminution - pour [S]=f(t).
Il apparaît donc qu'on peut concevoir la notion de vitesse initiale en enzymologie standard comme une notion expérimentale : c'est la vitesse de réaction, en début de réaction, pendant la durée où elle apparaît comme quasi-constante. Et le phénomène peut durer depuis quelques secondes jusqu'à de longues minutes ! Impressionnant quand ça dure de longues minutes ...
Ou autrement dit : en début de réaction, la vitesse d[P]/dt = -d[S]/dt est quasi-constante pendant une certaine durée et est appelée vitesse initiale.
Evidemment la durée expérimentale de vitesse initiale va dépendre de la qualité du dispositif expérimental à mettre en évidence le fait que la vitesse diminue "doucement peu à peu"- quand bien même cette décélération est très lente depuis le début de l'expérience ! Mais cet effet de vitesse initiale qui dure parfois de longues minutes va nous mettre "la puce à l'oreille" pour envisager une modèlisation théorique avec complexe enzyme-substrats et mise en place ultra-rapide d'un état quasi-stationnaire de réaction !