Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2010-2022
[A propos de l'auteur]
[Droits de copie]
En effet, lorsque la réaction retour P->S peut être négligée (soit parce qu'on est face à une réaction irréversible soit parce qu'on est en début de réaction et donc que très peu de P a été produit), la vitesse de réaction peut s'exprimer par v = k0 [ES] où k0 désigne le coefficient catalytique de l'enzyme E pour le substrat S dans les conditions expérimentales données.
Et, en début de réaction pendant l'état quasi stationnaire d[ES]/dt≈0 et donc v =k0 [ES] ≈constante. Cette vitesse particulière pendant la phase quasi stationnaire est appelée vitesse initiale vi.
Note très importante : l'état quasi stationnaire indiqué ci-dessus apparaît parce que l'enzyme est en concentration catalytique (donc très faible devant [S]) et parce que la réaction retour est négligeable (il y a encore très peu de P, ou mieux : la réaction S->P est irréversible).
La phase quasi stationnaire est en fait précédée d'une phase pré-stationnaire durant laquelle [ES] augmente depuis zéro pour se stabiliser à une quasi constance. Mais les valeurs des coefficients de vitesse des réactions sont telles que cette phase préstationnaire a une durée si faible qu'elle n'est pas observable avec des technologies classiques et des systèmes de mélange des réactifs qui durent de l'oredre de la seconde. (Des techniques particulières comme le "stop flow" permettent de suivre la phase préstaionnaire ...)
Le schéma ci-dessous illustre les évènements ([E]l désigne la concentration en enzyme libre et [ES] celle en complexe ES).
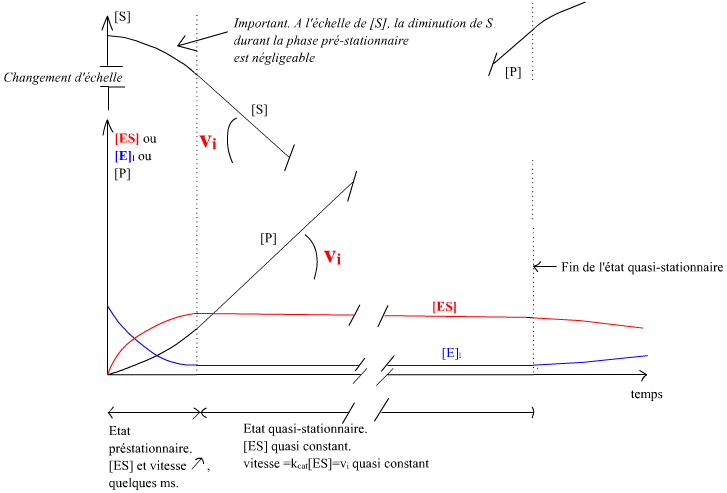
Les échelles de concentrations pour l'enzyme et le substrat n'ont rien à voir ! Par construction expérimentale [S]àt=0 >>> [Enzyme totale] .
L'état préstationnaire, de durée très brève, n'est pas observable avec les techniques expérimentales classiques.
Ainsi, expérimentalement, aux échelles de temps observées et aux échelles de [S] et [P], on mesure :
 |
Technique expérimentale classique : période préstationnaire non
détectée. |
C'est Victor Henri, qui vers 1903, en utilisant ses travaux et des données de ses prédécesseurs, propose le premier modèle cinétique formel de la catalyse enzymatique; avec complexe enzyme-substrat et avec les calculs de comportement cinétique associés ! (Voir le paragraphe intitulé "modèle de Henri"). Mais les résultats expérimentaux ne sont pas toujours très convaincants, notamment (on le sait maintenant) car ses milieux réactionnels ne sont pas tamponnés ...
Un peu plus tard Michaelis et Menten (la première canadienne docteur en médecine ) valident les idées de Henri en travaillant dans des conditions correctement standardisées et en précisant la notion de vitesse initiale. Nous sommes entre 1905 et 1913. L'équation de Michaelis-Menten-Henri est née. On l'appelle généralement équation de Michaelis en oubliant Menten et Henri ...