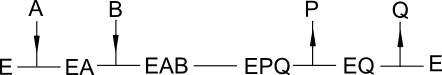Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2010-2022
[A propos de l'auteur]
[Droits de copie]
Les modéles de Henri Michaelis Menten et Briggs Haldane sont très simplistes puisque le complexe ES se transforme en une seule étape en produit P et enzyme libre E. Tout ça paraît évidemment trop simple. Autre critique, le modèle ne prévoit qu'un substrat et un produit, chose très rare. Voici quelques explications tentant de montrer pourquoi nos deux modèles historiques simplistes restent néanmoins très pertinents.
Plus "réaliste" que le modèle de Michaelis-Menten et pour envisager vraiment des réactions réversibles, le modèle avec complexe EP s'écrit :
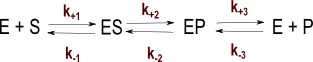 ou pour une réaction irréversible
ou pour une réaction irréversible 
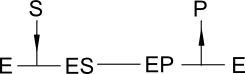
Ce modèle a le gros avantage de montrer la possibilité des inhibitions par le produit P de réaction.
Du point de vue de son traitement cinétique formel, la résolution de ce modèle à l'état quasi-stationnaire dans les conditions de vitesse initiale est :
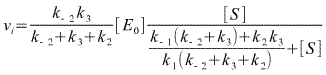
Où on voit bien ci-dessus que l'équation de vitesse a été mise sous forme michaélienne et que k0 (coefficient catalytique) et Km (coefficient de Michaelis) apparaissent comme combinaison des différents coefficients de vitesse.
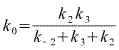 (On remarquera que si la réaction est irréversible (
k-2=0) et si l'acte catalytique est lent devant les associations
dissociations des complexes enzymes produit (k2 petit devant
k3), k0≈k2, le coefficient de vitesse de
l'acte catalytique, étape limitante du processus).
(On remarquera que si la réaction est irréversible (
k-2=0) et si l'acte catalytique est lent devant les associations
dissociations des complexes enzymes produit (k2 petit devant
k3), k0≈k2, le coefficient de vitesse de
l'acte catalytique, étape limitante du processus).
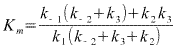 Si l'expression "cinétique" est évidemment différente de ce
qu'on a vu pour les modèles de Henri et Briggs et Haldane, la signification
reste la même, Km a les dimensions d'une concentration et correspond
à la concentration en substrat qui conduit à vmax/2. On remarquera
aussi que si la réaction est irréversible ( k-2=0) et si l'acte
catalytique est lent devant les associations dissociations des complexes ES et
EP (k2 petit devant k1 et k-1 et k3
et k3), k0≈k-1/k1. On
retrouve évidemment le modèle de Henri !
Si l'expression "cinétique" est évidemment différente de ce
qu'on a vu pour les modèles de Henri et Briggs et Haldane, la signification
reste la même, Km a les dimensions d'une concentration et correspond
à la concentration en substrat qui conduit à vmax/2. On remarquera
aussi que si la réaction est irréversible ( k-2=0) et si l'acte
catalytique est lent devant les associations dissociations des complexes ES et
EP (k2 petit devant k1 et k-1 et k3
et k3), k0≈k-1/k1. On
retrouve évidemment le modèle de Henri !
Encore plus réaliste ! Car il faut bien que la catalyse passe par un état de transition vers le produit catalysé. Le modèle devient :
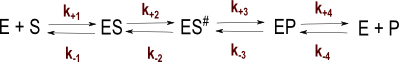
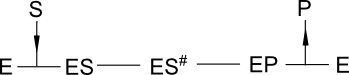
Mais ça ne change rien, l'état quasi stationnaire de vitesse initiale donnera une formalisation cinétique michaélienne ! On aura simplement des formules un peu plus complexes encore pour l'expression de k0 et Km en fonction des différents coefficients cinétiques.
Les réactions enzymatiques qui ne mettent en jeu qu'un seul substrat et un seul produit sont rares puisqu'elles ne concernent que les isomérisations. La plupart des réactions enzymatiques impliquent 2 voire 3 substrats et libèrent 2 voire 3 produits. Toute la puissance du modèle Michaélien réside dans le fait qu'on va obtenir un comportement michaélien à 1 seul substrat et un seul produit en se plaçant comme un observateur qui ne regarde qu'un substrat comme variable (le ou les autres substrats sont en concentration paramétrique constante dans le milieu réactionnel) et un seul produit de réaction. Ceci est expliqué dans "Notion expérimentale de vitesse initiale" accessible à l'aide du menu en haut à gauche ou par le lien michaelis_1.php
Ce chapitre n'a pas pour objet de présenter le comportement michaélien des réactions à plusieurs substrats et plusieurs produits. Pour cela, voir "Comportement Michaélien et réactions à plusieurs substrats et produits"
Mais pour information, voici 3 modèles de réactions qui conduisent à des comportements michéliens quand un substrat est la variable observée, l'autre substrat étant paramétrique. A et B désignent les substrats, P et Q les produits.
Chemin réactionnel dit "ping pong" : 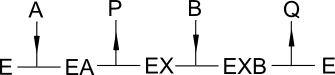
Chemin réactionnel ordonné à complexe ternaire : 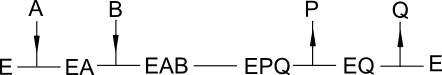
Chemin réactionnel à fixation et libération aléatoire des substrats et
produits et complexe ternaire :